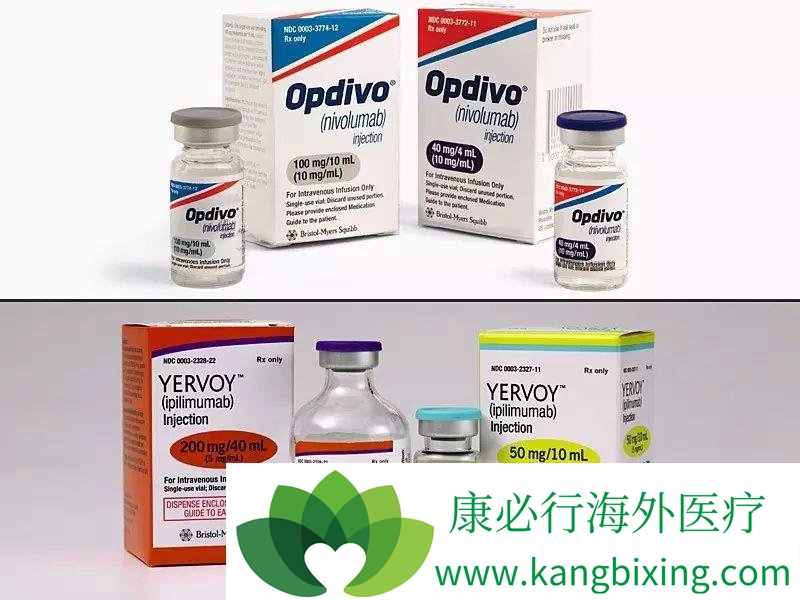
无论PD-L1状态如何,FDA已经批准了奈韦单抗(Opdivo),用于治疗以前的索拉非尼(Nexavar)之后的肝细胞癌(HCC)患者。
该批准是基于154名入选I / II期CheckMate-040试验的患者,其中通过盲法独立中央评估(BICR)的总体反应率(ORR)为18.2%,每个mRECIST标准为先前已被治疗索拉非尼。此外,3.2%的患者经历了完全的反应。RECIST1.1的ORR为14.3%,nivolumab的反应持续时间为3.2〜38.2个月。
“近年来,越来越多的兴趣利用免疫肿瘤学知识和发现来增加晚期肝癌患者的治疗方案,”Anthony B. El-Khoueiry,MD,主要研究者和副教授南加州大学凯克大学医学院(USC)的临床医学和I期项目主任以及USC诺里斯综合癌症中心在一份声明中说。“Opdivo的批准为我们提供了一个令人鼓舞的方法,并为先前的全身治疗后适当的HCC患者提供了新的治疗方案。

在CheckMate-040试验中,从2012年11月26日至2016年8月8日期间,共有262例晚期HCC患有丙型肝炎病毒(HCV)或乙型肝炎病毒(HBV)感染的患者入组。 - 放化期和214例患者在剂量扩张阶段。剂量递增阶段的百分之七十七,扩张期患者的百分之七十八是先前的索拉非尼。
在升级阶段,患者每2周接受0.1至10 mg / kg的IV尼维单胺。扩张阶段的患者每2周接受3mg / kg的尼莫单抗。FDA的批准是专门为每2周240毫克的剂量。
升级阶段患者的中位年龄为62岁(范围55-69岁),75%为男性,58%为白人,40%为ECOG表现状态(PS)为1.75%手术切除,21%接受放疗。在扩张阶段,患者的中位年龄为64岁(范围为56-70岁),80%为男性,49%为白人,47%为亚裔,36%为ECOG PS为1.60%的患者手术切除,19%接受放疗。
根据2017年ASCO年会上发现的研究结果,在索拉非尼经验丰富的阶段(n = 145),BICR的mRECIST ORR为19%。通过RECIST v1.1,有2个完整的反应(1%),19个部分反应(13%)和60个疾病稳定的患者(41%)。疾病控制率(DCR; ORR加稳定型疾病)为56%。
在剂量扩张和升级队列(n = 80)的索拉非尼初始组中,BICR的ORR为RECIST v1.1的20%,mRECIST为24%。v1.1分析显示1例完全缓解(1%),15例部分反应(19%),27例疾病稳定(34%)。中位时间为17个月。
在治疗扩张队列中,总生存期(OS)为15.6个月(95%CI,13.2-18.9)。12个月操作系统率为60%,18个月率为44%。在索拉非尼初始组中,nivolumab的中位OS为28.6个月。12个月和18个月的OS率分别为73%和57%。
反应倾向于早期发生;索拉非尼初次患者中56%和64%的索拉非尼有反应的患者在3个月内就发生了这种情况。50%的索拉非尼无效患者和39%的索拉非尼有经验的患者正在接受反应。

调查人员评估了升级和扩张阶段的安全。二十三名索拉非尼原始患者(29%)经历3/4级治疗相关不良事件(TRAEs),78%经历了任何级别的TRAE。最常见的(³10%)任何级别的TRAE是瘙痒(24%),疲劳(20%),皮疹(16%)和腹泻(13%)。最常见(≥5%)3/4级TRAEs AST升高(9%),脂肪酶增加(8%),淀粉酶增加(6%)和ALT增加(5%)。
在索拉非尼经验的组中,77%的患者经历了任何级别的TRAE,18%的患者具有3/4级TRAE。最常见的(≥10%)任何级别的TRAE是疲劳(22%),瘙痒(20%),皮疹(18%)和腹泻(14%)。最常见的3/4级TRAEs是疲劳(4%),AST增加(4%),脂肪酶增加(4%)。
调查人员观察到1剂量限制性毒性,2级肝损伤在剂量递增阶段。没有达到最大耐受剂量。一名索拉非尼患者因治疗相关性肺炎而死亡。
Bristol-Myers Squibb美国商业总裁Chris Boerner表示:“我们为通过免疫肿瘤学治疗的临床意义反应的潜力为这些晚期HCC患者带来了自豪,多年来这些HCC患者的治疗选择有限。”一份声明。“今天的批准标志着我们实现转基因药物治疗高度未满足需求的条件的重要一步。”
尼维单抗的批准取决于较大试验的结果。nivolumab与索拉非尼的III期随机试验已在前线设置启动,入选目标为726例。主要完成日期为2018年10月(NCT02576509)。



 添加康必行顾问,想问就问
添加康必行顾问,想问就问