阿哌利西是一款口服小分子α特异性PI3K抑制剂,其有效成分可以特异性抑制PI3K/AKT激酶(或蛋白激酶B)信号传导途径中的PIK3,从而抑制PI3K信号传导途径的激活。奥拉帕利为PARP抑制剂,可以通过抑制肿瘤细胞DNA损伤修复,导致BRCA突变肿瘤细胞死亡。在临床前模型中,在PARP抑制剂中加入PI3K抑制剂可以改善BRCA1富集型和BRCA1缺陷型肿瘤的治疗效果。此前一项IB期试验(NCT01623349)曾报道奥拉帕利与联合治疗高级别浆液性卵巢癌患者的安全性和Ⅱ期临床研究推荐剂量(RP2D)[2]。本研究探讨了联合奥拉帕利在TNBC和/或BRCA突变乳腺癌患者中的疗效和安全性。
在本IB期临床试验(NCT01623349)中,入组患者患有复发TNBC或携带胚系BRCA突变的任何亚型的复发乳腺癌。其他入组标准包括:年龄≥18岁、ECOG评分为0/1、预期寿命超过4个月、具有根据RECIST1.1标准可测量病灶、正常的器官功能和经患者知情同意。既往系统治疗线数不限;复发转移性TNBC患者必须接受过至少一种治疗转移性乳腺癌的化疗方案或在完成辅助化疗1年内发生转移。剂量递增队列组患者允许既往使用PARP抑制剂和PI3K抑制剂,但剂量扩展队列组患者不允许。
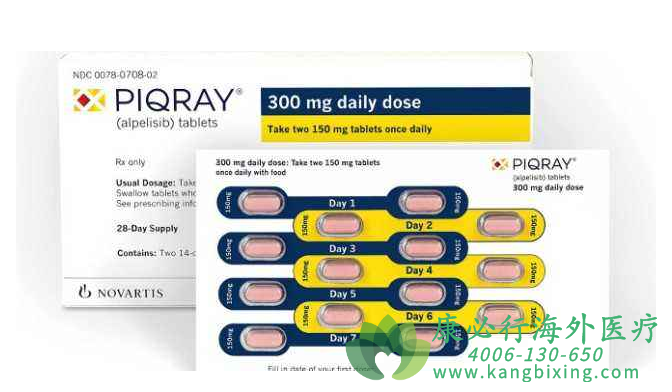
奥拉帕利和阿哌利西片剂口服28天/周期。该研究分为四个剂量水平:(1)起始剂量水平阿哌利西 250mg QD+奥拉帕利100mg BID(剂量水平0);(2)阿哌利西 250mg QD+奥拉帕利200mg BID(剂量水平1);(3)阿哌利西 300mg QD+奥拉帕利200mg BID(剂量水平2);(4)阿哌利西 200mg QD+奥拉帕利200mg BID(剂量水平3)。剂量扩展队列使用剂量水平3方案。治疗至发生疾病进展或不可耐受的毒性时停止。每8周(两个周期)根据RECIST1.1进行肿瘤评估,包括行胸部、腹部和骨盆CT或MRI检查。完成16周期后,每12周进行一次肿瘤评估。根据不良事件通用术语标准(CTCAE)4.03版评估毒性。
共纳入来自哈佛大学Dana-Farber癌症研究所四个中心的17例TNBC患者。4例患者纳入剂量递增队列(剂量水平0-2),13例患者纳入剂量扩展队列(剂量水平3)。截至2020年4月,17例患者均完成治疗,中位随访时间为11.8个月(IQR:4.8-19.6)。患者基本情况如下。在所有患者中,发生率不低于10%的3-4级治疗相关不良事件包括高血糖(18%)和皮疹(12%)。最常见的各级不良事件包括疲劳(71%)、厌食(59%)、高血糖(59%)和恶心(53%)。未发生治疗相关死亡。2例患者发生高血糖和发热性中性粒细胞减少的剂量限制毒性。在剂量水平3队列中,1例患者在第一周期第21天时因高血糖而停止治疗。
在该研究中,3例患者(18%,95%CI:3.8–43.4)观察到部分缓解,7例患者(41%)观察到疾病稳定。部分缓解的3例患者均无胚系BRCA突变,其中1例患者入组前经卡铂治疗后发生疾病进展。在7例疾病稳定的患者中,3例患者疾病稳定超过6个月。
客观缓解率(ORR,完全或部分缓解)为18%,临床获益率(缓解或疾病稳定至少6个月)为35%(95%CI:14.2-61.7),疾病控制率(缓解或疾病稳定至少3个月)为53%(95%CI:27.8-77)。所有观察到部分缓解的患者均接受RP2D,即阿哌利西 200mg QD+奥拉帕利 200mg BID,该部分患者的ORR为23%(3/13)(95%CI:5-53.8)。在6/17(35%)例患者中观察到任何程度的肿瘤缩小。中位缓解持续时间为7.4个月。中位无进展生存期为3.6个月(95%CI:1.8-9.2),6个月无进展生存率为31.2%(95%CI:11.4-53.6)。中位总生存期为11.8个月(95%CI:4.2-19.6)。
该研究表明奥拉帕利联合阿哌利西方案安全且可耐受。虽然结论受限于小样本,但该联合方案在重度预处理患者群中显示出抗肿瘤活性,缓解率和临床获益率分别为18%和35%。仍需进行更大样本的前瞻性随机研究和生物标志物探索,以确定最有可能从奥拉帕利联合阿哌利西口服方案获益的患者群。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:阿哌利西/阿培利司(ALPELISIB)在治疗乳腺癌的临床研究中效果如何?
更多药品详情请访问 阿哌利西 https://www.kangbixing.com/drug/apls/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问