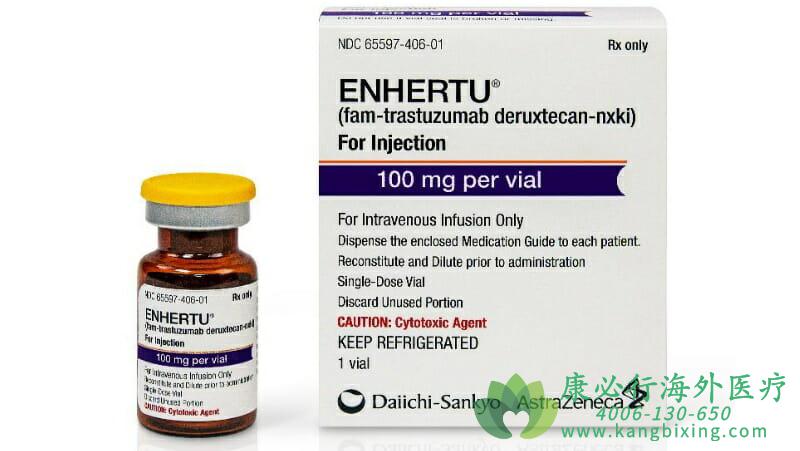
Enhertu(DS-8201)是靶向HER2的创新抗体偶联药物(ADC),它将靶向HER2受体的全人源化单克隆抗体trastuzumab(曲妥珠单抗)通过四肽接头与一种新型拓扑异构酶1抑制剂exatecan衍生物(DX-8951衍生物,DXd)连接在一起。这款ADC能够在抗体上连接更多的细胞毒素,从而可能具有更好的杀伤肿瘤的效果。可靶向递送细胞毒制剂至癌细胞内,与通常的化疗相比,可减少细胞毒制剂的全身暴露。
2020年9月,Enhertu获得日本厚生劳动省(MHLW)批准,用于治疗HER2阳性、无法切除的晚期或复发胃癌患者。Enhertu曾在美国获得孤儿药称号(ODD),用于治疗转移性胃癌和胃食管结合部癌患者。Enhertu还获得了FDA的突破性疗法称号,用于治疗转移性非小细胞肺癌患者,这些患者的肿瘤有HER2突变,且在铂类化疗后疾病仍进展。
FDA的这一批准基于随机、关键二期DESTINY-Gastric 01试验的积极结果。研究在来自日本和韩国的188例晚期胃癌或胃食管连接腺癌患者中评估Enhertu的安全性与有效性。这些患者肿瘤呈现HER2阳性,且经在包括氟嘧啶(5-FU)、铂类化疗和曲妥珠单抗的两种或多种方案治疗后依然发生了进展。试验结果已在2020年美国临床肿瘤学会(ASCO)会议上发表,并发表在《新英格兰医学杂志》上。
结果显示:
1、在中期分析中,与化疗(紫杉醇或伊立替康单药治疗)组患者相比,Enhertu治疗组的患者的死亡风险降低了41%;治疗组的中位总生存期为12.5个月,而化疗为8.4个月
2、Enhertu治疗组的客观缓解率为40.5%,而化疗组为11.3%,客观缓解率提高了3倍以上!
3、与化疗组相比,Enhertu治疗组的中位反应持续时间(DoR)为11.3个月VS 3.9个月。
4、Enhertu组的中位无进展生存期(PFS)为5.6个月,而化疗为3.5个月(HR = 0.47)。
Enhertu是首个获FDA批准的、用于治疗转移性胃癌患者的抗体偶联药物,与化疗相比,该药使得患者的生存期提高了41%,缓解率提高了3倍以上。这不仅代表着该药在治疗这种难治性疾病方面的重大进展,还有望重新定义这类患者的一线标准疗法。不过,这项试验中发现少数患者(10%)使用新药治疗时出现了间质性肺疾病和胚胎胎儿毒性。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:如何使用ENHERTU/DS-8201?有什么需要注意的事项?
更多药品详情请访问 Enhertu https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问