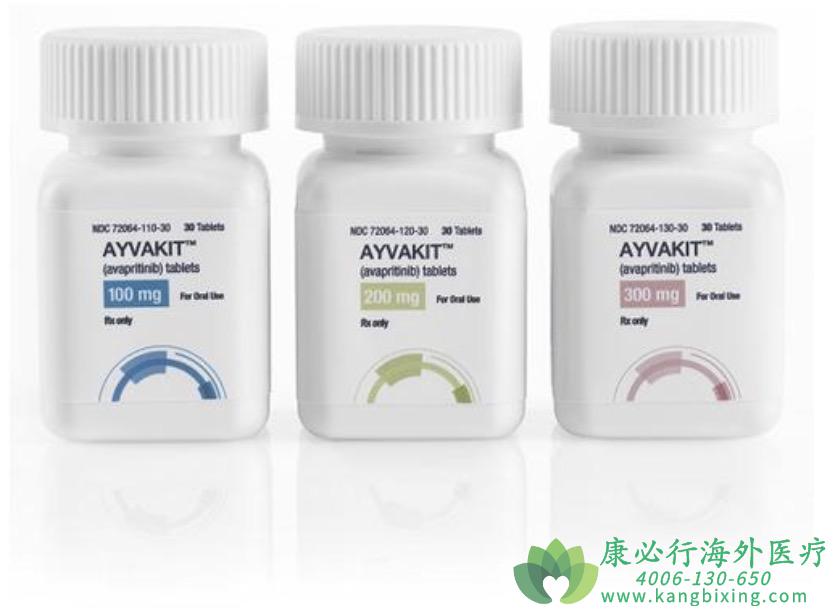
Ayvakit(avapritinib,阿伐普替尼)是Blueprint Medicines开发的一款强效、高选择性KIT和PDGFRA突变激酶抑制剂,可通过直接与导致突变KIT和PDGFRA信号传导的活性激酶构象结合,进而起到肿瘤抑制作用。与已批准的多激酶抑制剂相比,avapritinib对KIT和PDGFRA的选择性明显高于其他激酶。临床前研究表明,avapritinib能以亚纳摩尔效力强效抑制KIT D816V,并具有最小的脱靶活性。
系统性肥大细胞增多症(SM)是一种罕见的克隆增生性血液肿瘤,95%病例由KIT D816V突变引起。不受控制的肥大细胞增殖和活化可能会导致危及生命的并发症。晚期系统性肥大细胞增多症(AdvSM)包括侵袭性肥大细胞增多症(ASM)、伴有相关血液肿瘤的肥大细胞增多症(SM-AHN)和肥大细胞白血病(MCL),罹患上述晚期SM的患者经治疗后预后仍旧较差,ASM的中位总生存期(OS)约为3.5年,SM-AHN的中位OS约为2年,MCL的中位OS不到6个月。FDA已批准阿伐普替尼Ayvakit(avapritinib)用于治疗晚期系统性肥大细胞增多症(SM)成人患者,包括:侵袭性SM(ASM)、伴有相关血液肿瘤的SM(SM-AHN)和肥大细胞白血病(MCL)等亚型。
在SM领域,阿伐普替尼曾被FDA授予治疗SM的突破性药物资格。此次获批使阿伐普替尼成为首个针对KIT D816V突变的SM精准疗法,而其获批治疗SM的基于I期研究EXPLORER和II期研究PATHFINDER的数据。这2项研究中,85例患者根据改良的IWG-MRT-ECNM标准(IWG标准)进行疗效评估,注册终点是基于中心审查的总缓解率(ORR)和缓解持续时间(DOR)。2020年9月,Blueprint宣布公布这两项研究取得阳性顶线结果。
EXPLORER研究,截止2020年5月27日,53例患者可评估缓解,中位随访时间为27.3个月,ORR为76%,36%的患者实现CR/CRh。中位DOR为38.3个月。中位OS不可估计。
PHTHFINDER研究预先指定的一项中期分析显示:32例患者可评估缓解,中位随访时间为10.4个月,ORR为75%,19%的患者实现CR/CRh。此外,随着时间的推移,缓解在继续加深,其速度与EXPLORER试验一致。该研究的顶线结果基于一项预先计划的分析,旨在评估阿伐普替尼与之前报道的根据IWG标准确定的多激酶抑制剂midostaurin的ORR(28%)的优越性,中期分析达到了主要终点。
200mg QD剂量组的汇总疗效分析中,有44例患者可进行疗效评估,中位随访时间为10.4个月,该组中ORR为68%,18%的患者实现CR/CRh。
安全性方面,研究中未出现新的安全性信号,阿伐普替尼总体耐受性良好,大多数不良事件(AE)报告为1级或2级。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:阿伐普替尼/阿泊替尼(AYVAKIT)是胃肠道间质瘤新靶向疗法?
更多药品详情请访问 阿伐普替尼 https://www.kangbixing.com/drug/awptn/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问