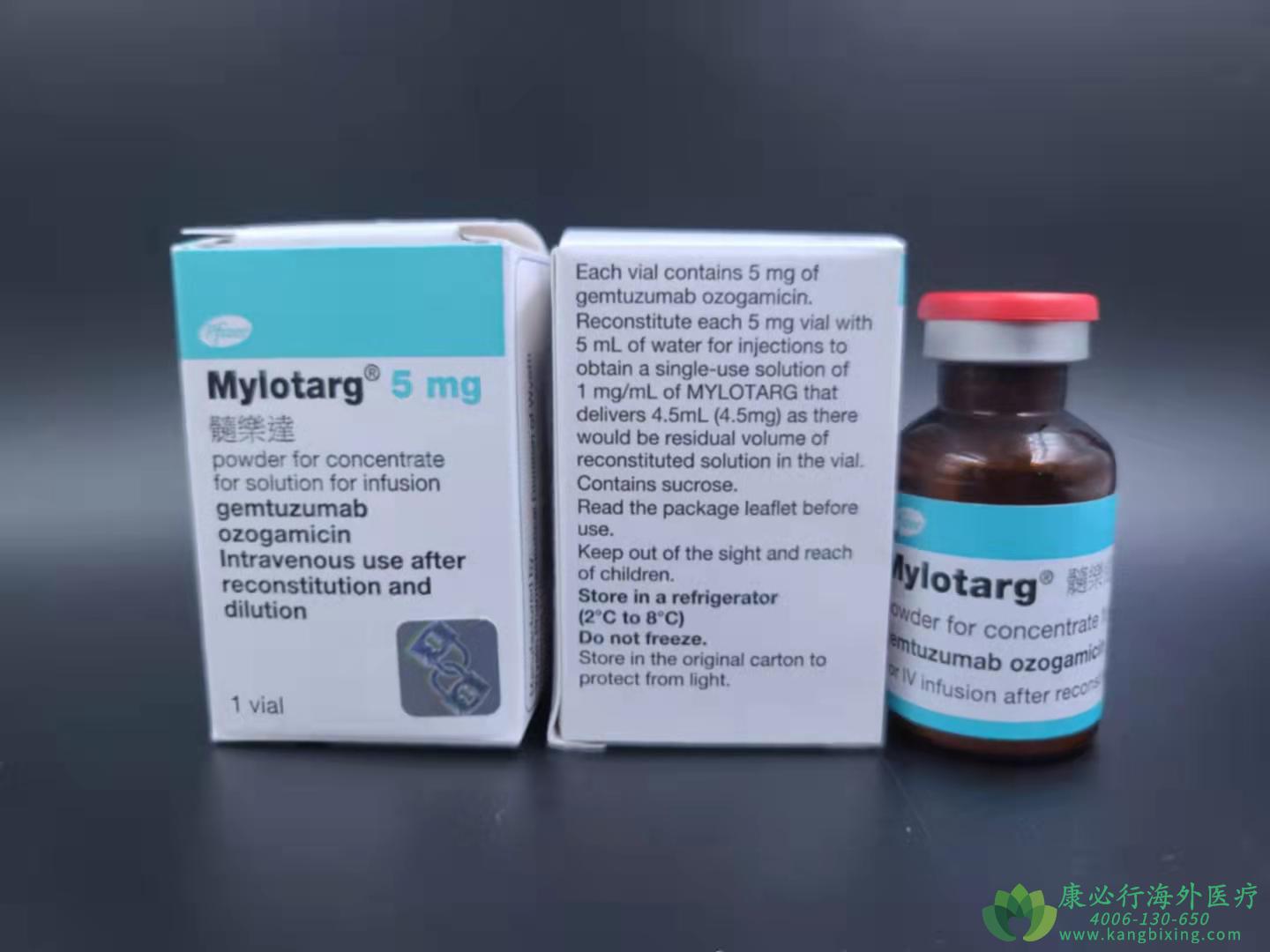
美国食品和药物管理局批准吉妥珠单抗(gemtuzumab ozogamicin)用于治疗新诊断的、肿瘤表达CD33抗原的急性骨髓性白血病(CD33阳性AML)成人患者。FDA还批准吉妥珠单抗用于治疗2岁及以上的CD33阳性AML患者,这些患者经历了复发或对初始治疗没有反应(难治性)。
吉妥珠单抗获得加速批准,作为一种独立的治疗方法,用于治疗经历过复发的CD33阳性AML老年患者。在随后的确认性试验未能验证临床效益并显示出安全性问题(包括大量的早期死亡)后,吉妥珠单抗自愿退出市场。今天的批准包括一个较低的推荐剂量,一个与化疗联合或单独使用的不同时间表,以及一个新的病人群体。
"美国食品和药物管理局肿瘤学卓越中心主任、美国食品和药物管理局药物评估和研究中心血液学和肿瘤学产品办公室代理主任Richard Pazdur医学博士说:"我们是在仔细审查了新的给药方案后批准吉妥珠单抗的,该方案显示这种治疗的益处超过了风险。"吉妥珠单抗的历史强调了研究癌症患者的替代剂量、时间安排和管理疗法的重要性,特别是那些可能最容易受到治疗副作用影响的患者。"
AML是一种快速发展的癌症,在骨髓中形成,导致血液中白细胞数量增加。美国国立卫生研究院的国家癌症研究所估计,今年将有大约21380人被诊断为急性髓细胞白血病,10590名急性髓细胞白血病患者将死于该疾病。
吉妥珠单抗是一种靶向治疗,由一种连接到对细胞有毒性的抗肿瘤剂的抗体组成。它被认为是通过将抗肿瘤剂带到表达CD33抗原的AML细胞,阻断癌细胞的生长并导致细胞死亡而发挥作用。
一项针对271名新诊断的CD33阳性AML患者的试验研究了吉妥珠单抗与成人化疗联合使用的安全性和有效性,这些患者随机接受吉妥珠单抗与达诺比星和阿糖胞苷联合使用,或接受达诺比星和阿糖胞苷而不接受吉妥珠单抗。该试验测量了 "无事件生存率",或者说,从开始试验之日起,患者在多长时间内没有出现某些并发症,包括对治疗没有反应、疾病复发或死亡。与单独接受化疗的患者相比,接受吉妥珠单抗联合化疗的患者无并发症的时间更长(中位数,无事件生存期为17.3个月对9.5个月)。
在两项独立的试验中,对吉妥珠单抗作为独立治疗的安全性和有效性进行了研究。第一个试验包括237名新诊断的急性髓细胞白血病患者,他们不能忍受或选择不接受强化化疗。患者被随机分配接受吉妥珠单抗治疗或最佳支持性护理。该试验测量了 "总生存期",或患者从开始试验之日起存活的时间。接受吉妥珠单抗治疗的患者比只接受最佳支持性护理的患者存活时间更长(中位总生存期为4.9个月,比3.6个月)。第二项试验是一项单臂研究,包括57名经历过一次疾病复发的CD33阳性AML患者。患者接受了一个单疗程的吉妥珠单抗。该试验衡量了有多少患者获得了完全缓解。在使用吉妥珠单抗治疗后,26%的患者实现了完全缓解,持续时间中位数为11.6个月。
吉妥珠单抗的常见副作用包括发热(热射病)、恶心、感染、呕吐、出血、血液中血小板水平低(血小板减少症)、口腔肿胀和溃疡(口腔炎)、便秘、皮疹、头痛、肝功能测试升高和某些白细胞水平低(中性粒细胞减少症)。吉妥珠单抗的严重副作用包括低血细胞计数、感染、肝脏损伤、肝脏内静脉阻塞(肝静脉闭塞症)、输液相关反应和严重出血(出血)。怀孕或哺乳期的妇女不应服用吉妥珠单抗,因为它可能对发育中的胎儿或新生儿造成伤害。对吉妥珠单抗或其制剂的任何成分过敏的病人不应使用吉妥珠单抗。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 吉妥珠单抗 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问