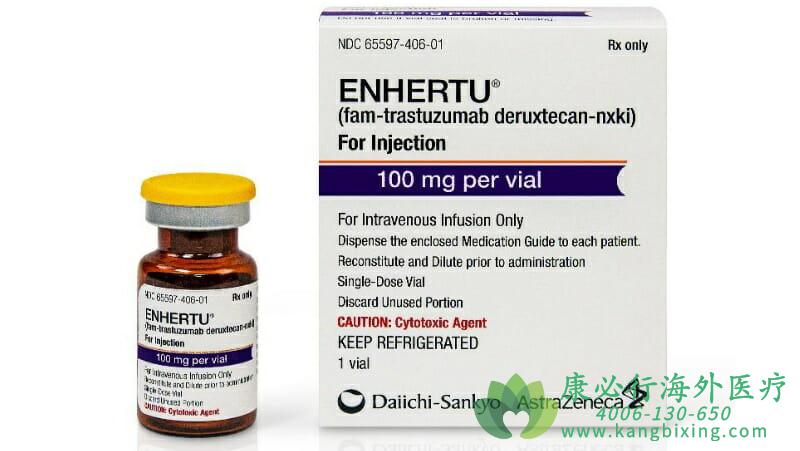
2019年12月21日,美国FDA宣布,加速批准第一三共(Daiichi Sankyo)和阿斯利康(AstraZeneca)共同开发,靶向HER2的抗体偶联药物(ADC)ENHERTU上市,治疗接受过2种或以上抗HER2疗法的治疗的无法切除或转移性HER2阳性乳腺癌患者。某年7月19日,阿斯利康(AstraZeneca)和第一三共(Daiichi Sankyo)联合宣布,Enhertu(DS-8201,trastuzumab deruxtecan)在欧盟(EU)获批新适应症,作为一种单一疗法,用于治疗既往接受过一种或多种基于抗HER2方案治疗的不可切除或转移性HER2阳性乳腺癌成年患者。临床数据研究表明,与曲妥珠单抗(T-DM1)相比,Enhertu将患者的疾病进展或死亡风险降低了72%。
此次Enhertu在欧盟获批新适应症主要是基于DESTINY-Breast03试验的结果,该试验发表在《新英格兰医学杂志》上。该试验的研究对象是既往接受过曲妥珠单抗和紫杉烷治疗的HER2阳性不可切除和/或转移性乳腺癌患者。试验数据显示,与曲妥珠单抗(T-DM1)相比,Enhertu将患者的疾病进展或死亡风险降低了72%(HR=0.28;95%CI;0.22-0.37;p<0.000001)。
DESTINY-Breast03的其它研究结果还表明,在次要终点总生存期(OS)方面,Enhertu表现出了改善OS的现象(HR=0.55;95%CI 0.36-0.86),但该分析尚未成熟,进一步的分析正在进行中。此外,几乎所有接受Enhertu治疗的患者(96.1%)在9个月时依然存活,而接受曲妥珠单抗(T-DM1)治疗的患者为91.3%。在客观缓解率(ORR)方面,与曲妥珠单抗组(T-DM1)相比,Enhertu组增加了一倍以上(79.7%vs 34.2%)。
Enhertu最常见的不良反应有:恶心(79%)、疲劳(59%)、呕吐(47%)、脱发(46%)、表明(35%)、食欲下降(32%)、贫血(31%)、腹泻(29%)、嗜中性白血球减少症(29%)、白血球减少症(22%)、白血球减少症(20%)、咳嗽(20%)、腹痛(19%)、头痛(19%)、上呼吸道感染(15%)。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:ENHERTU/DS-8201的警告和注意事项有哪些?
更多药品详情请访问 Enhertu https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问