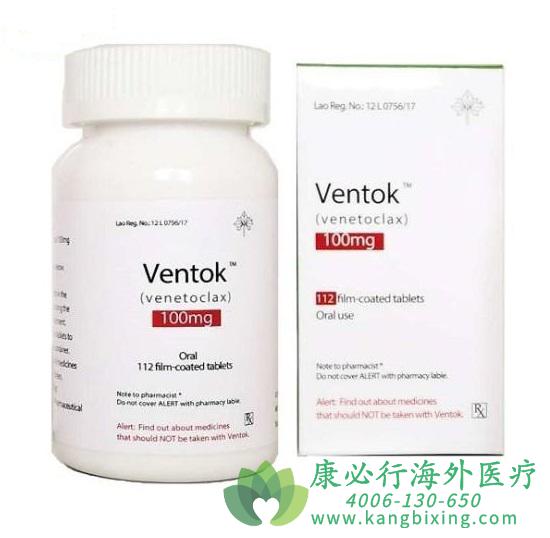
艾伯维(AbbVie)与罗氏(Roche)近日联合宣布,美国食品和药物管理局(FDA)已批准维奈克拉(venetoclax)联合Rituxan(美罗华,通用名:rituximab,利妥昔单抗)用于治疗存在或不存在17p删除突变且既往已接受至少一种疗法治疗的慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者。随着此次批准,维奈克拉+美罗华方案将为病情复发的CLL/SLL患者群体提供一种新的无化疗治疗选择,与标准护理方案相比能显著延长无进展生存期。
维奈克拉+美罗华方案是通过FDA的优先审查通道批准,之前还被授予了突破性药物资格。在《美国国家综合癌症网络(NCNC)》指南中,维奈克拉+美罗华方案已被推荐作为既往已接受治疗的CLL患者的一个治疗选择。
此次批准是基于III期临床研究MURANO的数据。该研究显示,与标准护理化疗免疫方案(苯达莫司汀+美罗华)相比,固定持续时间的维奈克拉+美罗华方案治疗使复发性或难治性CLL(R/R CLL)患者无进展生存期(PFS)显著延长、疾病进展或死亡风险显著降低81%、总缓解率(ORR)大幅提高(92% vs 72%)。安全性方面,维奈克拉+美罗华方案最常见的不良反应(发生率≥20%)为中性粒细胞减少、腹泻、上呼吸道感染、疲劳、咳嗽和恶心。
此次批准也将维奈克拉的加速批准转为了完全批准。此外,FDA还更新了维奈克拉单药疗法的适应症,该药现在被批准用于存在或不存在17p删除且既往已接受至少一种疗法治疗的CLL和SLL患者。在2016年4月,维奈克拉曾获FDA加速批准,作为一种单药疗法用于存在17p删除且既往已接受至少一种疗法的CLL患者。
维奈克拉是一种口服的B细胞淋巴瘤因子-2(BCL-2)抑制剂,BCL-2在细胞凋亡(程序性细胞死亡)中发挥重要作用,可阻止一些细胞(包括淋巴细胞)的凋亡,并且在某些类型癌症中过度表达,与耐药性的形成相关。venetoclax旨在选择性抑制BCL-2的功能,恢复细胞的通讯系统,让癌细胞自我毁灭,达到治疗肿瘤的目的。
维奈克拉由艾伯维与罗氏合作开发,双方共同负责该药在美国市场的商业化,艾伯维负责美国以外市场的商业化。目前,双方正在开展一个大型临床项目,调查维奈克拉单药及组合疗法治疗多种类型血癌,包括CLL、霍奇金淋巴瘤(NHL)、弥漫性大B细胞淋巴癌(DLBCL)、急性髓性白血病(AML)和多发性骨髓瘤(MM)等。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 维奈克拉 https://www.kangbixing.com/drug/wntk/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问