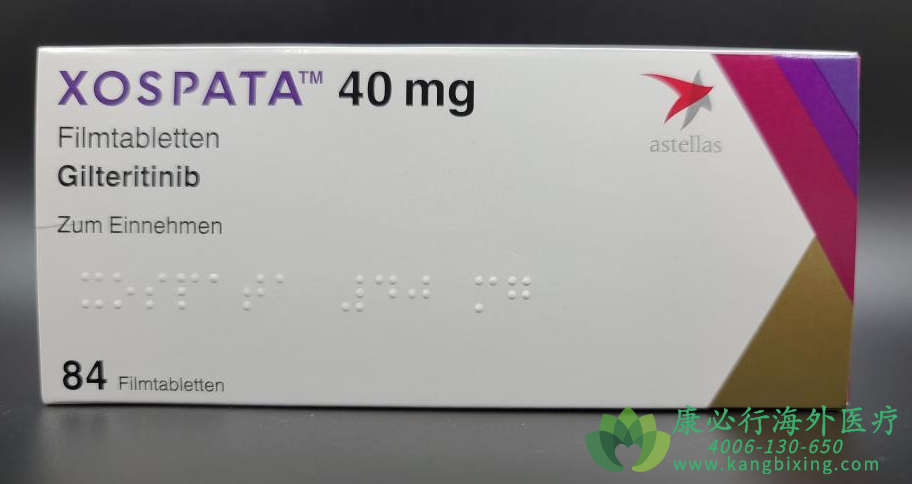
吉瑞替尼Xospata(gilteritinib)是由Astellas Pharma(安斯泰来制药)生产的一种片剂药物,该药在去年经美国FDA批准后用于治疗存在FLT3突变的复发或难治性急性髓性白血病(AML)的成人患者。FDA还批准了LeukoStrat CDx FLT3 Mutation Assay用于检测AML患者的FLT3突变。Xospata由日本安斯泰来制药与日本寿制药株式会社(Kotobuki Pharmaceutical)合作研究发现,安斯泰来拥有开发、制造、潜在商业化Gilteritinib的独家全球权利。
吉瑞替尼(GILTERITINIB)是一种有效、选择性、可口服的FMS样酪氨酸激酶3(FLT3)抑制剂。ADMIRAL III期研究(NCT02421939)在复发性/难治性FLT3突变阳性急性髓系白血病(AML)患者中进行了吉瑞替尼与挽救化疗(SC)的对比,基于此研究的中期分析结果,吉瑞替尼成为首个被批准用于AML单药治疗的FLT3抑制剂。此次报告公布了ADMIRAL研究的最终结果。
能有效改善白血病患者的总生存和缓解率?
共371例患者随机分配接受治疗,吉瑞替尼组和SC组分别有247例和124例(MEC,25.7%;FLAG-IDA,36.7%;LoDAC,14.7%;AZA,22.9%)。中位年龄为62岁(范围,19~85岁)。基线FLT3突变状态为:FLT3-ITD,88.4%;FLT3-TKD,8.4%;FLT3-ITD突变和FLT3-TKD突变,1.9%;突变状态未知,1.3%。总体而言,39.4%的患者是难治性AML,60.6%的患者是复发性AML。
接受吉瑞替尼治疗的患者的OS(9.3个月)显著优于SC组(5.6个月;HR=0.637;P=0.0007);1年生存率分别为37.1%和16.7%。吉瑞替尼组和SC组的CR/CRh率分别为34.0%和15.3%(P=0.0001);两组的CR率分别为21.1%和10.5%(双侧P=0.0106)。两组的中位EFS分别为2.8个月和0.7个月(HR 0.793,P=0.0830)。
所有患者的常见不良事件(AE)为发热性中性粒细胞减少症(43.7%)、贫血症(43.4%)和发热(38.6%)。与吉瑞替尼相关的常见≥3级AE是贫血(19.5%)、发热性中性粒细胞减少(15.4%)、血小板减少症(12.2%)和血小板计数减少(12.2%)。校正给药持续时间后,吉瑞替尼组每例患者每年的严重治疗不良事件比SC组少,分别为7.1%和9.2%。
与化疗相比,吉瑞替尼明显改善了复发/难治性FLT3突变阳性AML患者的总生存和缓解率,并且具有更好的安全性。这些结果改变了复发/难治性FLT3突变阳性AML患者挽救治疗的治疗模式,也为吉瑞替尼成为新的治疗标准提供了依据。Gilteritinib是通过阻断癌细胞上的FLT3和其他蛋白质来抑制细胞生长的药物。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 吉瑞替尼 https://www.kangbixing.com/drug/jltn/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问