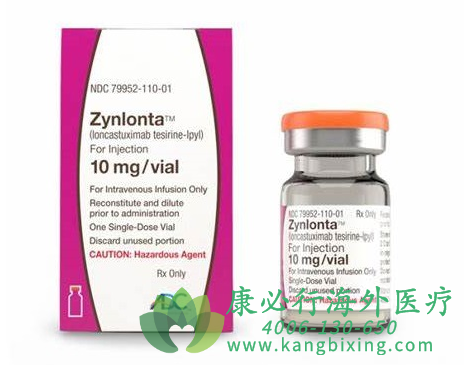
朗妥昔单抗是一种靶向CD19的ADC药物,由人源化抗人CD19单克隆抗体,通过连接子(Linker)与载荷药物(Payload)吡咯并苯并二氮杂卓(pyrrolobenzodiazepine,PBD)二聚体细胞毒素偶联而成。美国食品药品监督管理局(FDA)已批准朗妥昔单抗(loncastuximab tesirine-lpyl)用于治疗经过两线或多线全身治疗后复发或难治性(r/r)大B细胞淋巴瘤的成年患者,包括未指定的DLBCL,由低级别淋巴瘤引起的DLBCL以及高级别B细胞淋巴瘤。该试验纳入了广泛的患有难以治疗疾病的重度预治疗患者(中位数三线治疗),包括对一线治疗无反应的患者、对先前所有治疗无效的患者、双重/三重命中遗传学患者以及在用朗妥昔单抗治疗之前接受干细胞移植和CAR-T治疗的患者。该适应症由FDA根据总体缓解率加速批准,该适应症的持续批准可能取决于验证性试验中对临床益处的验证和描述。
该批准基于LOTIS-2的数据,LOTIS-2是朗妥昔单抗的一项大型(n=145)2期多国单臂临床试验,用于治疗先前接受过两线或更多线全身治疗后的复发或难治性DLBCL成年患者。2021年4月,美国食品药品监督管理局(FDA)批准朗妥昔单抗作为首个CD19靶向抗体药物偶联物(ADC)作为单药治疗,用于治疗经过两线或更多线全身治疗后复发或难治性DLBCL成人患者。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 朗妥昔单抗 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问