在丙型肝炎病毒在1989年被发现从那时起显著的研究,测试和公众健康意识的提高,导致了HCV传播以及治疗导致治疗的下降。自1989年以来,干扰素一直是治疗选择的主要组成部分,但是近年来已经提供了新的药物显示更高的持续病毒学应答(SVR)率,特别是对于世界上最主要的基因型的基因型1。
以下是概述美国HCV和治疗方案的历史的时间表:
1970年,非甲非乙型肝炎在20世纪70年代中期得到认可。虽然非A型非乙型肝炎最初被认为是微不足道的,但后来他们意识到,这种疾病往往会对肝硬化甚至癌症进行沉默。努力确定其原因并寻求可能阻碍其进展的药物治疗。
1989年,确定丙型肝炎病毒!
1991年,第一个丙型肝炎治疗由FDA批准。食品和药物管理局(FDA)批准了丙型肝炎 - 先灵葆雅内含子A的第一次治疗。不幸的是,最初的治疗导致很少有人清除病毒。
1992年,对美国血液供应进行HCV检测。尽管丙型肝炎的常规检测始于1990年,但对美国血液供应的更为敏感的测试几乎可以消除所有血库的HCV。
1997年,FDA批准Infergen(干扰素alfacon-1)注射液有时与利巴韦林组合用于治疗18岁及以上患有补偿性肝病的患者的慢性HCV。

1998年,FDA批准将Merck'sRebetol(利巴韦林)与干扰素α-2b(聚乙二醇化和非聚乙二醇化)注射剂联合用于治疗3岁以上患有补偿性肝病的患者的慢性丙型肝炎。此外,Schering-Plough宣布,FDA已批准将Rebetol和Intron的组合使用作为Rebetron进行销售,用于治疗经干扰素治疗复发的补偿性肝病患者的慢性丙型肝炎。
2001年,Merck的Pegintron(聚乙二醇化干扰素α-2b)注射液经FDA批准,用于治疗患有补偿性肝病的慢性HCV患者。对于某些患者,聚乙二醇干扰素α-2b可以与利巴韦林一起服用。
2002年,Genentech公司生产的Pegasys(聚乙二醇干扰素α-2a)于10月份被FDA批准用于治疗慢性HCV作为联合治疗的一部分。
12月,Genentech公司获得FDA批准的版本的利巴韦林(Copegasus)。Copegasus用于治疗慢性丙型肝炎病毒感染,与Pegasys联合治疗5岁及以上患有补偿性肝病的患者,以前未用干扰素α治疗以及与艾滋病毒共感染的成年人接受治疗。
2011年,5月13日,FDA批准了Victrelis(boceprevir)治疗慢性丙型肝炎基因型1感染,与聚乙二醇干扰素α和利巴韦林联合治疗,在成年患者中,补偿性肝病,包括肝硬化,以前未经治疗或以前失败干扰素和利巴韦林治疗,包括先前的无效应答者,部分反应者和复发者。
10天后,5月23日,Incivek(telaprevir)被FDA批准与聚乙二醇化干扰素α和利巴韦林组合用于治疗补偿性肝病的成年人中的基因型1 HCV感染,包括肝硬化,治疗无效或以前曾接受干扰素治疗的患者,包括先前的无效应答者,部分反应者和复发者。
2013年,11月,FDA批准Olysio(simeprevir)胶囊与聚乙二醇干扰素α和利巴韦林或与sofosbuvir组合使用。其效力建立在丙型肝炎基因型1的患者中。除了其他限制之外,对于那些以前的治疗方案(包括simeprevir或其他HCV蛋白酶抑制剂)未见失败者,不建议使用辛普达韦。
下个月,FDA批准Sovaldi(sofosbuvir)片剂与利巴韦林或聚乙二醇化干扰素和利巴韦林组合使用。其效力建立在丙型肝炎基因型1,2,3或4的患者中,包括肝细胞癌肝移植患者和丙型肝炎/艾滋病毒共感染者。治疗时间通常为12-24周。

2014年,美国食品药品管理局在10月份批准了不需要干扰素或利巴韦林的哈佛尼诺(达波替韦/ sofosbuvir)片剂的FIRST每日一次药片。该药用于治疗丙型肝炎,基因型1感染。
两个月后,FDA批准Viekira Pak(ombitasvir / paritaprevir / ritonavir和dasabuvir)口服联合治疗,用于治疗1型HCV感染患者,包括补偿性肝硬化患者。使用限制包括失代偿期肝病患者。
2015年,Daklinza(daclatasvir)于7月份被批准用于sofosbuvir,作为慢性丙型肝炎病毒基因型3患者的首个12周全面口服治疗方案。HCV基因型3感染肝硬化患者的SVR率降低。
7月份也批准了Technivie(ombitasvir,paritaprevir和ritonavir)与利巴韦林组合用于治疗不具有瘢痕形成和肝功能差(肝硬化)的HCV基因型4感染。Technivie是首批经过无干扰素治疗基因型4 HCV感染的药物。
2016年,1月28日,Zepatier,Elbasvir和grazoprevir的组合,有或没有利巴韦林获得FDA批准。试验表明,基因型1患者的持续病毒学应答率(SVR)高达97%,基因型4患者达到100%。
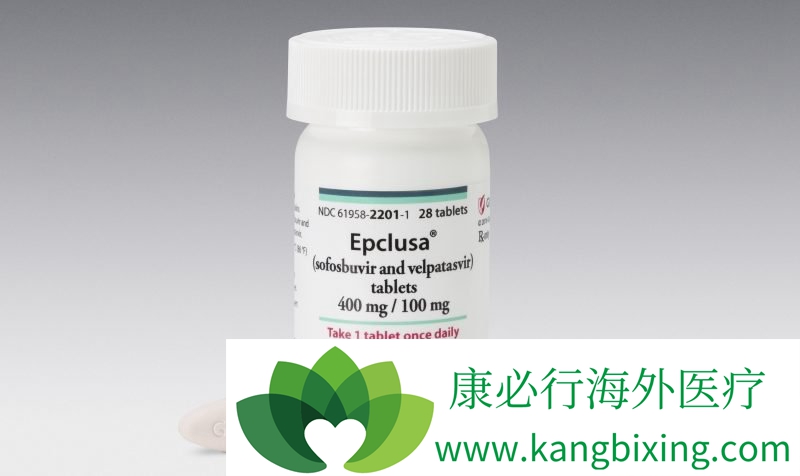
Epclusa(sofosbuvir / velpatasvir)于6月28日被批准为第一个全口服单片剂治疗基因型1-6型慢性丙型肝炎病毒感染的成年人。Epclusa也是批准用于治疗HCV基因型2和3的患者的第一个单一平板药物方案,而不需要利巴韦林。12周后,98%的Epclusa患者达到SVR,94%的代偿失代偿性肝硬化患者服用利巴韦林的Epclusa达到SVR。
2017年,Mavyret(glecaprevir和pibrentasvir)于8月被批准为未经过治疗的所有没有肝硬化的HCV基因型的第8周治疗。试验结果表明,治疗8周,12周或16周后接受Mavyret治疗的92-100%的患者在治疗后12周内血液中没有检测到病毒,表明患者的感染已经治愈。
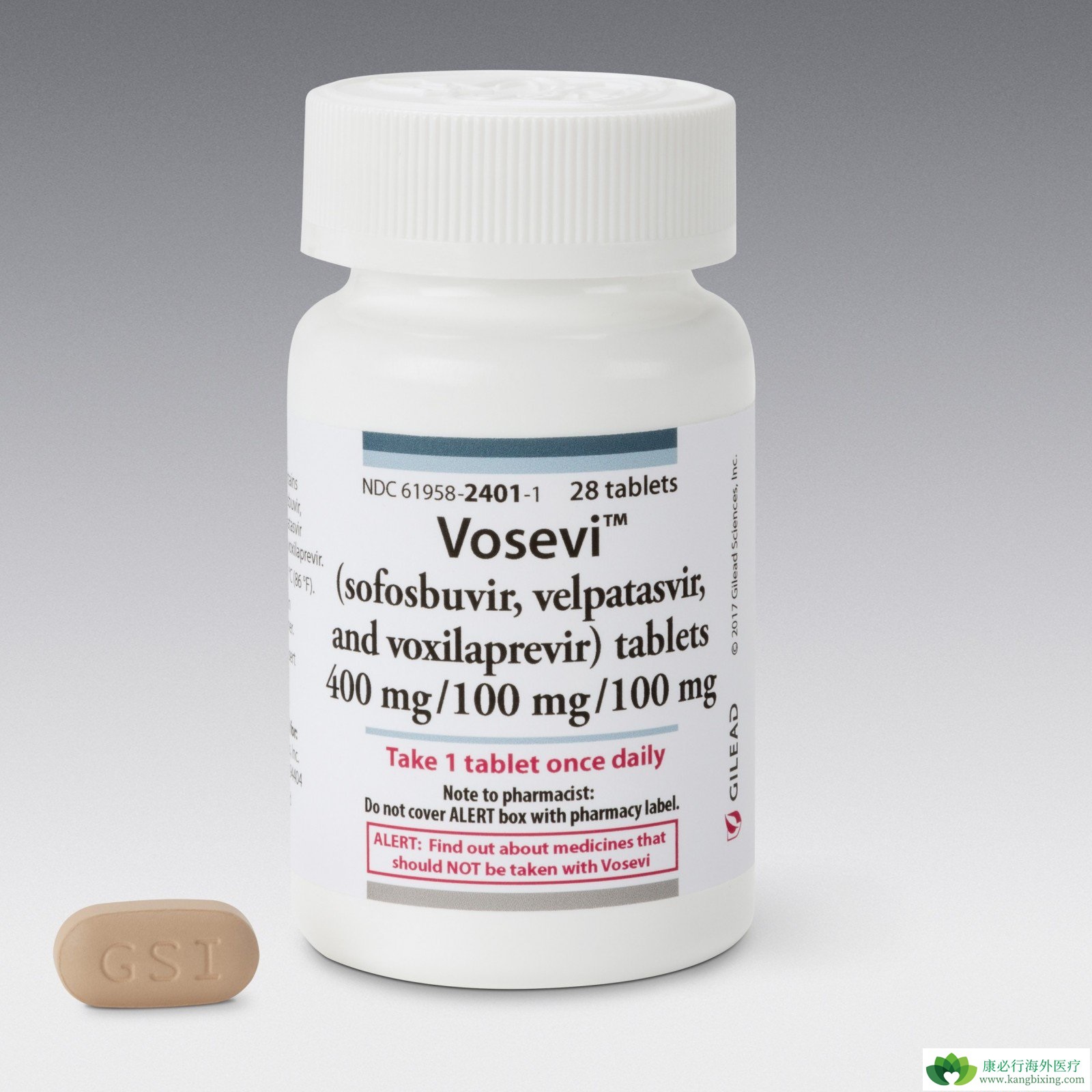
2017年7月18日,FDA批准Gilead的Vosevi(sofosbuvir,velpatasvir和voxilaprevir)作为第一个每日一次的单表方案,被批准用于已经用直接作用的抗病毒药物sofosbuvir等进行治疗的基因型1-6的患者用于HCV抑制称为NS5A的蛋白质的药物。试验证实,96-97%接受Vosevi的患者在完成治疗后12周内没有检测到血液中的病毒,表明患者的感染已经治愈。



 添加康必行顾问,想问就问
添加康必行顾问,想问就问