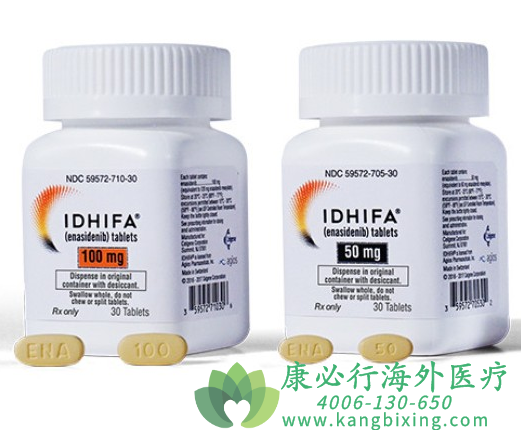
2017年8月1日,美国食品和药物管理局正式批准恩西地平IDHIFA(enasidenib)用于治疗异柠檬酸脱氢酶-2(IDH2)突变的复发或难治性急性髓系白血病(AML)成年患者。这是FDA第一次批准用于治疗IDH2突变的复发或难治性AML的药物。FDA同时批准了一个配套的诊断方法,即实时IDH2检测,用于检测IDH2突变。2017年8月1日,美国食品和药物管理局正式批准恩西地平IDHIFA(enasidenib)用于治疗异柠檬酸脱氢酶-2(IDH2)突变的复发或难治性急性髓系白血病(AML)成年患者。这是FDA第一次批准用于治疗IDH2突变的复发或难治性AML的药物。FDA同时批准了一个配套的诊断方法,即实时IDH2检测,用于检测IDH2突变。
一项纳入了199例复发性或难治性AML患者的单臂临床试验对恩西地平的有效性进行了评估,经RealTimeIDH2检测试剂盒检测,纳入者均为带有IDH2基因突变的患者。该试验评估了治疗后无疾病症状且血细胞计数完全恢复(称为完全缓解,CR)的患者百分比,以及治疗后无疾病症状且血细胞计数部分恢复(称为伴随血液学改善的完全缓解,CRh)的患者百分比。
通过至少6个月的治疗,有19%的患者在第8.2个月(中位数)时出现了CR结果,有4%的患者在9.6个月(中位数)时出现了CRh结果。该试验开始时,有157例患者因AML需要输全血或血小板,其中34%的患者在接受恩西地平治疗后不再需要输注血液或血小板。
恩西地平持续时间降至每个周期的14天,以缓解血细胞减少。在HMA治疗前患有难治性或进展性MDS的患者入组B组,并在28天周期中连续接受单独恩西地平(恩西地平)。主要终点为总缓解率(ORR)[完全缓解(CR)、骨髓CR(mCR)、部分缓解(PR)和血液学改善(HI)]。其他终点包括安全性和生存结局。
48例患者接受了恩西地平+AZA(n=26)或恩西地平(n=22)。中位年龄为73岁(范围为46–83岁)。大部分患者(72%)患有HMR:ASXL1(39%)和RUNX1(17%)。组中常见的治疗相关3-4级AE为中性粒细胞减少(64%)、血小板减少(28%)和贫血(8%);这些事件在恩西地平组的发生率分别为10%、0%和5%。组3例患者(12%)和恩西地平组5例患者(24%)发生IDH分化综合征。
如怀疑分化综合证,开始口服或静脉皮质激素(如,地塞米松[dexamethasone]10 mg每12小时)和血流动力学监视直至改善。仅在症状解决后滴定减低皮质激素。随过早终止皮质激素治疗可能复发分化综合证症状。如严重肺症状需要插管或呼吸机支持,和/或皮质激素的开始后肾功能不全持续共超过48小时,中断恩西地平直至体征和症状是不再严重。推荐住院为密切观察和监视有肺和/或肾表现的患者。
在缓解可评估的患者(n=46)中,初治A组的ORR为84%(n=21/25;24%CR+8%PR+44%mCR+8%HI],HMA失败恩西地平组的ORR为43%(n=9/21;24%CR+5%PR+5%mCR+10%HI)。中位随访12.6个月后,恩西地平+AZA组的中位OS为32.2个月,恩西地平组为21.3个月。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:恩西地平(IDHIFA/ENASIDENIB)为AML患者带来了新的动力与希望吗?
更多药品详情请访问 恩西地平 https://www.kangbixing.com/bxyw/exdp/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问