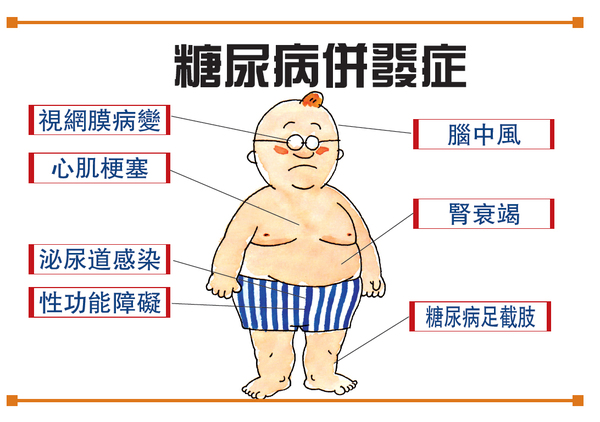
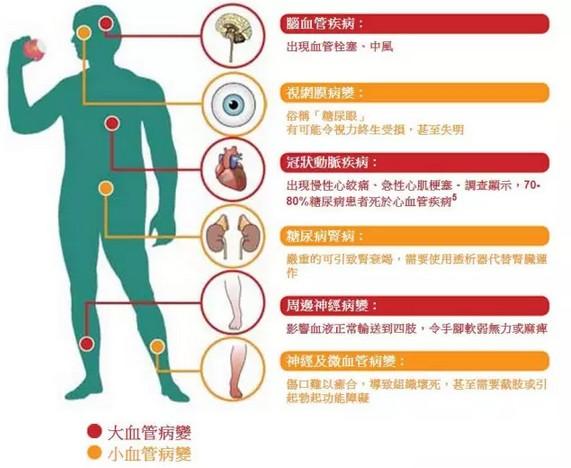
糖尿病是一种进展性疾病,病人需长期用药控制血糖。胰高血糖素样肽-1受体激动剂(GLP-1RA)类降糖药作为口服降糖药与胰岛素治疗之间的过渡疗法,具有延缓疾病进展的生物学作用,是目前全球最具市场潜力的降糖药之一。作为GLP-1的类似物,GLP-1RA的口服生物利用度差,很难通过胃肠道进入机体发挥药效。因此,在口服索马鲁肽上市之前,已上市的GLP-1RA类降糖药均为注射剂,给患者用药带来了不便与痛苦。
2019年9月20日,FDA正式批准了诺和诺德Rybelsus(口服索马鲁肽,每日1次)的上市申请,用于结合饮食和运动以改善2型糖尿病患者的血糖控制。2019年4月26日,诺和诺德向EMA提交了口服索马鲁肽用于2型糖尿病的上市申请。2019年7月,诺和诺德向日本PMDA提交了口服索马鲁肽的上市申请。
口服索马鲁肽与安慰剂及皮下注射索马鲁肽对2型糖尿病患者血糖控制的试验如下。2013年12月至2014年12月,在14个国家的100个地点(各医院诊所和临床研究中心)进行了一项2期、随机、平行组对照剂量研究试验。研究包括了26周的试验研究和5周的随访。在1106名被评估的受试者中,632名通过单独饮食及运动或稳定剂量的二甲双胍治疗血糖控制效果不佳的2型糖尿病患者被随机分组。
受试者被随机分配,接受每日一次口服2.5毫克(n=70)、5毫克(n=70)、10毫克(n=70)、20毫克(n=70),40毫克4周剂量递增(标准递增;n=71)、40毫克8周剂量递增(缓慢递增;n=70)、40毫克2周剂量递增(快速递增,n=70)的索马鲁肽;口服安慰剂(n=71;双盲)或每周皮下注射一次1.0毫克(n=70)索马鲁肽的治疗,给药持续26周。
主要终点是从试验前基线期到给药第26周糖化血红蛋白(HbA1c)的变化。次要终点包括体重和不良事件的变化。
共632名受试患者完成了试验。从试验开始时的基线期到给药后的第26周,与安慰剂组受试者相比,口服索马鲁肽组患者的HbA1c水平显著降低,其中口服2.5毫克组P=0.01,所有其他剂量组P<0.001。相较于安慰剂组,口服和皮下注射索马鲁肽对体重的降低作用更显著。各组的不良事件报告率分别为:口服索马鲁肽组63%-86%(490例受试者中371例),皮下索马鲁肽注射组81%(69例患者中56例),安慰剂组68%(71例患者中48例),其中最常见的是轻度至中度胃肠道不良反应事件。
诺和诺德公司开发的Rybelsus(口服索马鲁肽,每日1次)是口服GLP-1RA类降糖药,它打破了2型糖尿病患者需每天或每周接受GLP-1RA注射带来的不便和心理折磨窘境,为他们控制血糖提供了入侵性更小的便捷治疗选择;同时保持了相当或优于利拉鲁肽、恩格列净、西格列汀等主流药物的降糖和减重效果,对患者和医生都有极大的吸引力。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 索马鲁肽 https://www.kangbixing.com/drug/smlt/




 添加康必行顾问,想问就问
添加康必行顾问,想问就问