8月21日,国家药品监督管理局药品审评中心(CDE)官网显示,礼来的葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)受体双重激动剂替尔泊肽注射液(Tirzepatide)新适应症申报上市并获受理,用于在低热量饮食和增加运动基础上改善成人肥胖或伴有至少一种体重相关合并症的超重患者长期体重管理。
替尔泊肽(Tirzepatide)是首个且目前唯一的葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)受体激动剂。
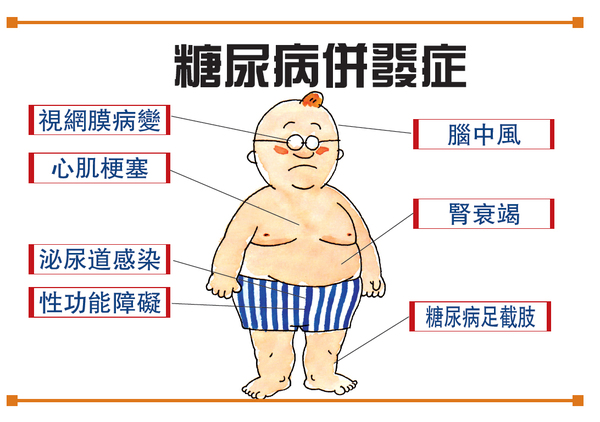
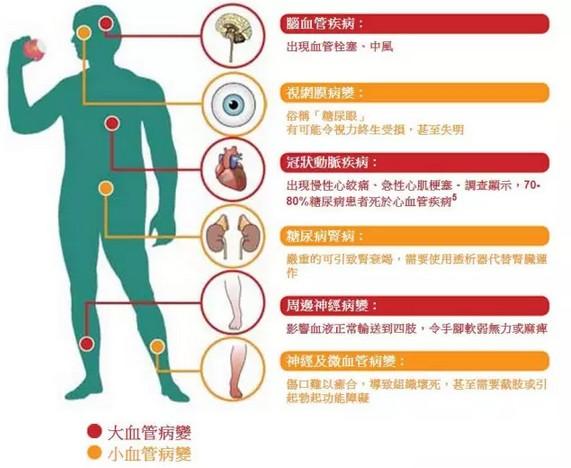
2022年5月,替尔泊肽获美国食品和药物管理局(FDA)批准用于改善成人2型糖尿病患者的血糖控制(在饮食控制和运动基础上),随后相继在欧盟、日本等国家获批。2022年9月,礼来在中国递交tirzepatide用于治疗成人2型糖尿病患者血糖控制注册申请,目前正在审评中。2022年10月,FDA授予tirzepatide用于改善肥胖或至少有一种合并症的超重成人的长期体重管理(在低热量饮食和增加体力活动基础上)适应症的快速通道资格,以加速该适应症的审批。
根据礼来官方消息,替尔泊肽用于成人长期体重管理适应症的注册申请是基于26项替尔泊肽临床研究结果,其中包括中国肥胖或超重注册临床试验SURMOUNT-CN。
SURMOUNT-CN是一项随机、双盲、安慰剂对照的III期研究,旨在评估每周注射1次替尔泊肽在肥胖或至少有一种合并症的超重的非糖尿病成人患者的有效性和安全性,共入组了210例中国患者(基线体重均值为91.8kg、BMI均值为32.3kg/m2)。
这些试验的共同主要终点结果显示,治疗52周时,tirzepatide 10mg和15mg治疗组体重自基线的平均变化百分比分别为-14.4%和-19.9%,优效于安慰剂组(-2.4%);替尔泊肽组(10mg,91.4%;15mg,92.7%)达到体重减轻≥5%的患者比例优效于安慰剂组(29.4%)。此外,替尔泊肽组(10mg,48.6%;15mg,72.1%)达到体重减轻≥15%的患者比例也优效于安慰剂组(2.9%)。
Tirzepatide的总体安全性与已知的GLP-1受体激动剂相似,最常见的不良反应为轻度至中度胃肠道不良反应,主要发生在剂量递增期,随持续给药而降低,绝大多数患者可耐受并坚持治疗。礼来表示,SURMOUNT-CN的结果将于今年10月在欧洲糖尿病研究协会(EASD)学术年会上公布。
根据礼来的财报,替尔泊肽全球正在快速放量,上半年销售额15.48亿美元,其中第二季度卖出9.8亿美元,预计全年销售额将超过40亿美元。在替尔泊肽的加持下,礼来市值目前已经突破5000亿美元。
从利拉鲁肽、度拉糖肽到司美格鲁肽,再到替尔泊肽,GLP-1药物无往不利,礼来、诺和诺德两大巨头尝尽甜头,目前在GLP-1赛道已经处于领先地位,并且还在不断加速。除了现阶段的相关产品,礼来还布局了口服GLP-1R激动剂Orforglipron和GLP-1R/GCGR/GIPR三靶点激动剂Retatrutide等新产品,均处于III期临床研发阶段,首发适应症将针对减重。GLP-1药物必将开启一个减肥新时代。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:替西帕肽/替尔泊肽(TIRZEPATIDE)的推荐剂量和使用方法
更多药品详情请访问 替尔泊肽 https://www.kangbixing.com/




 添加康必行顾问,想问就问
添加康必行顾问,想问就问