一项开放标签的国际3期随机对照试验中(NCT01728805),在美国、澳大利亚等的61个医疗中心招募了复发或难治性蕈样肉芽肿或Sézary综合征患者。莫格利珠单抗由日本协和麒麟公司(Kyowa)开发,2012年在日本上市,2018年获FDA突破性疗法认定和优先审评资格在美国上市(POTELIGEO mogamulizumab),是首个在美国获批的靶向CCR4的生物制品。
符合条件的患者年龄至少为18岁(在日本,≥20岁),至少有一次全身治疗失败(根据主要研究者的评估,进展或毒性),并且东部肿瘤合作小组的绩效得分为1或更低,血液、肝和肾功能良好。将患者随机(1:1)分配给莫格利珠单抗(在第一个28天周期内每周静脉注射1.0 mg/kg,然后在随后周期的第1天和第15天)或伏立诺他(每天400 mg)。按皮肤T细胞淋巴瘤亚型(蕈样肉芽肿vs Sézary综合征)和疾病分期(IB-II vs III-IV)进行分层。
与伏利诺司他治疗相比,莫格利珠单抗治疗的无进展生存率优于研究者评估的无进展存活率(莫格利珠单抗组中位7.7个月与伏立诺他组中位3.1个月;危险比0.53)。
莫格利珠单抗组184名患者中有75名(41%)患者报告了任何原因的3-4级不良事件,伏立诺他组186名患者中76名(41%)。
结论:与伏立诺他相比,莫格利珠单抗显著延长了无进展生存期,并可以为蕈样肉芽肿患者提供一种新的有效治疗方法,更重要的是,为Sézary综合征提供一种亚型,这是皮肤T细胞淋巴瘤的一个主要治疗挑战。
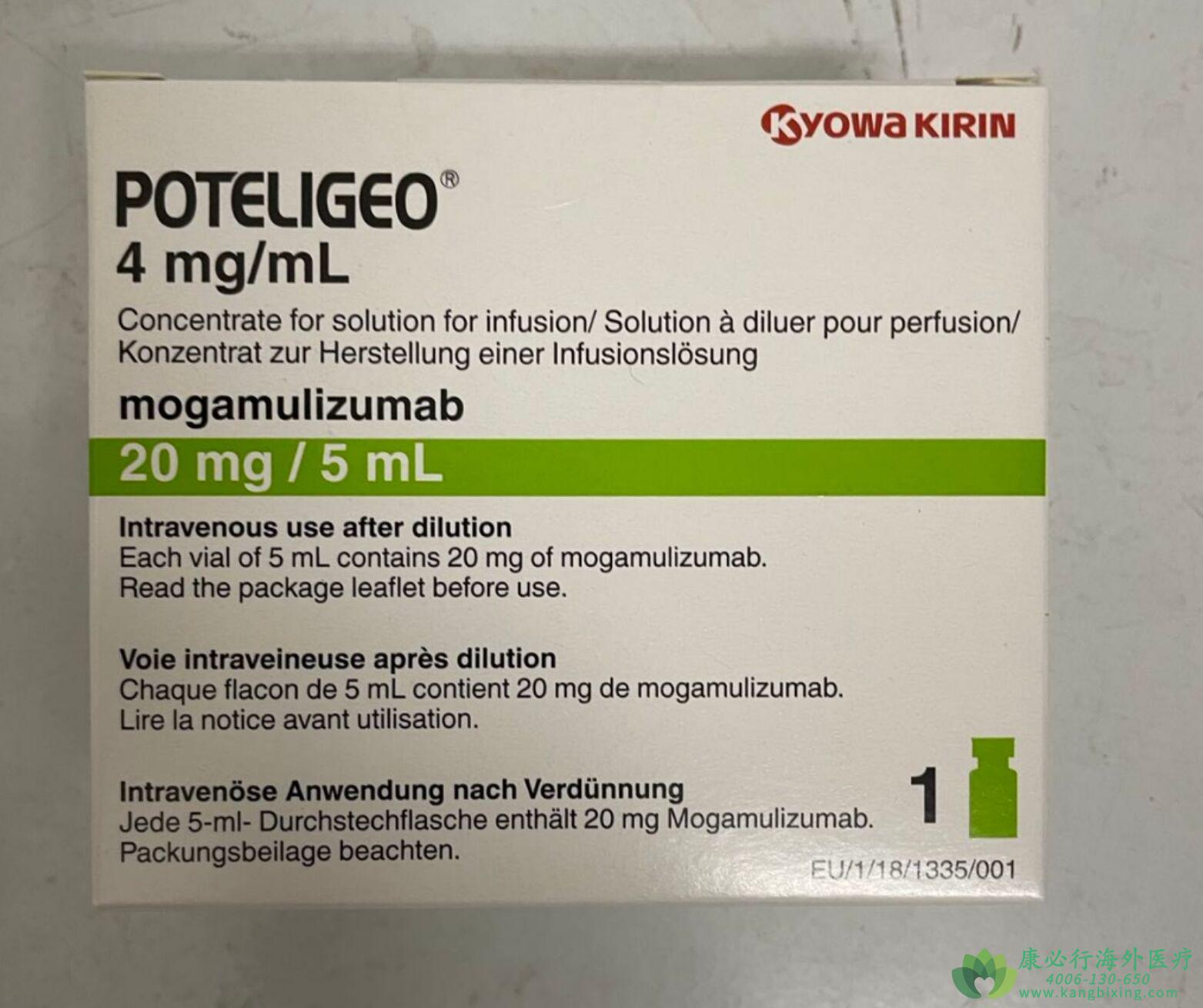
莫格利珠单抗是靶向CCR4的生物制剂,用于治疗既往接受过至少一种系统疗法的复发性或难治性MF(蕈样肉芽肿)或SS(Sézary综合征)患者,Sézary综合征为皮肤T细胞淋巴瘤,又称T细胞淋巴瘤性红皮病。莫格利珠单抗可以延长患者的生存期,提高生活质量。建议患者遵医嘱用药,对症治疗。
研究结果:372名符合条件的患者被随机分配接受莫格利珠单抗(n=186)或伏立诺他(n=186,包括意向治疗人群)。随机分配给莫格利珠单抗的两名患者在接受研究治疗前撤回了同意书;因此,370名患者被纳入安全人群。
莫格利珠单抗靶点CCR4,属于靶向CC亚家族G蛋白偶联受体4的生物制剂。趋化因子不仅在介导免疫细胞定向迁移中起重要作用,还能对免疫细胞进行活化。它们参与淋巴器官的形成和免疫细胞的发育,并在炎症反应中发挥关键作用。
此外,趋化因子还能启动和调控适应性免疫应答,并参与调节血管生成和细胞凋亡等过程。在自身免疫病和移植排斥反应等病理过程中也扮演重要角色。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 莫格利珠单抗 https://www.kangbixing.com/drug/mglz/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问












