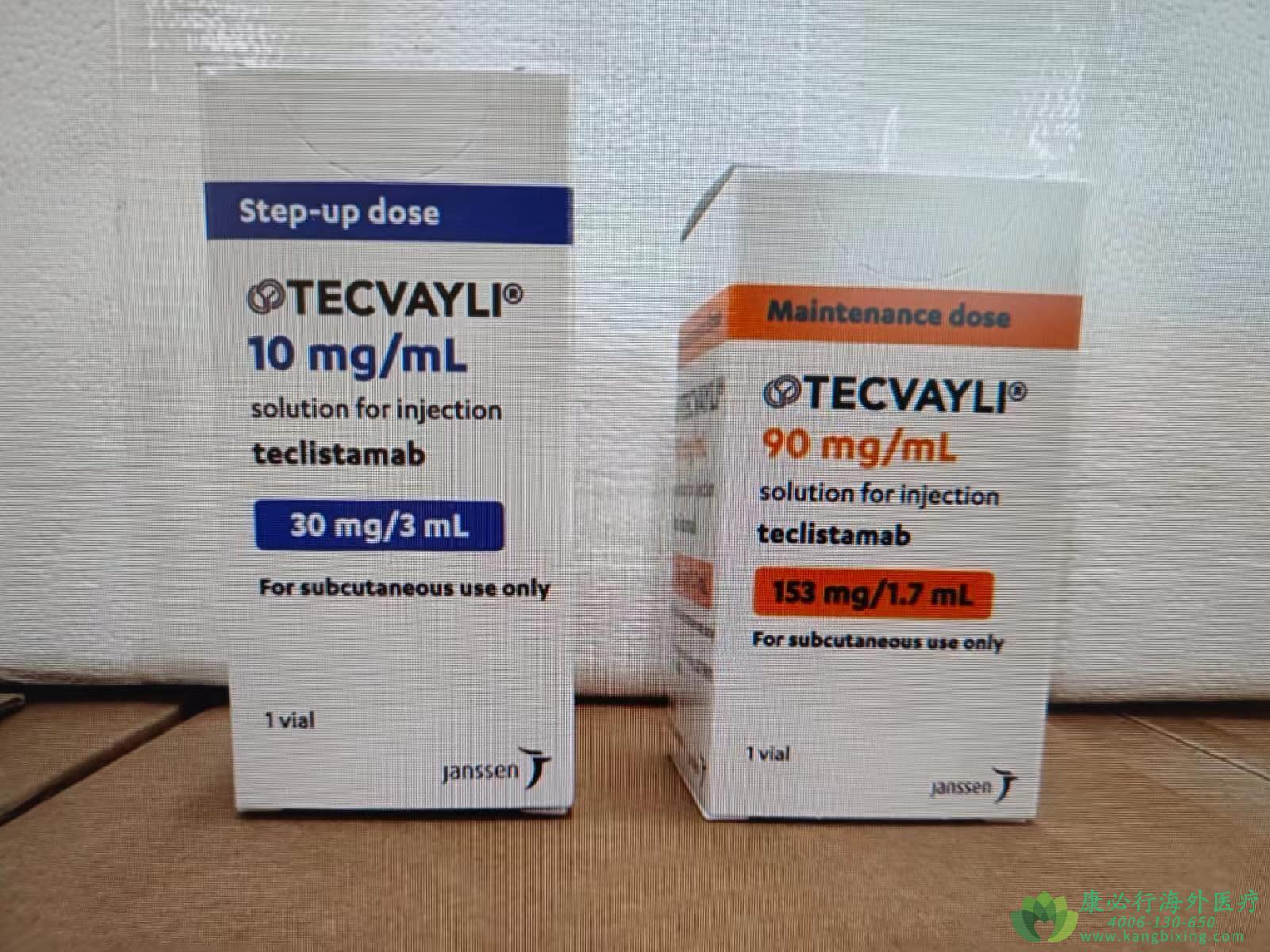
泰立珂(商品名)/特立妥单抗(Teclistamab,代号JNJ-64007957)是一款创新双特异性T细胞接合剂(BiTE)疗法。该药物于2022年获得美国食品药品监督管理局(FDA)的批准,用于治疗复发性和难治性多发性骨髓瘤,为这一难治性疾病提供了新的治疗选择。
药物特性与作用机制
特立妥单抗是一种人源化免疫球蛋白G4-脯氨酸、丙氨酸、丙氨酸(IgG4-PAA)双特异性抗体,能够同时结合T细胞表面的CD3受体和恶性多发性骨髓瘤细胞表面的B细胞成熟抗原(BCMA)。通过这种双重结合,特立妥单抗能够将T细胞重定向至表达BCMA的骨髓瘤细胞,并激活T细胞来攻击这些细胞。这种机制利用了患者自身的免疫系统来消除癌细胞,提供了一种新型的免疫疗法。
适应症与用法用量
特立妥单抗被批准用于治疗那些已经接受过至少三种治疗方案(包括免疫调节药物、蛋白酶体抑制剂和抗CD38抗体),且在最后一次治疗中出现疾病进展的复发和难治性多发性骨髓瘤成年患者。该药物的推荐剂量在逐步增加后为每周1.5 mg/kg皮下注射。具体用法包括:
初始剂量:每公斤体重0.06 mg。
第二剂量:每公斤体重0.3 mg,在第一次剂量后的2到7天内给予。
维持剂量:每公斤体重1.5 mg,在第二次剂量后的2到7天内给予,并每周维持此剂量,只要患者从治疗中获益。
临床试验结果
特立妥单抗的临床疗效在多项研究中得到了验证。在I/II期单臂、开放性、多中心的MajesTEC-1试验中,评估了特立妥单抗在复发或难治性多发性骨髓瘤患者中的安全性和有效性。该研究纳入了165名既往接受过至少三线治疗的患者,结果显示:
客观缓解率(ORR)为63%,其中46.1%的患者达到完全缓解(CR)或更好缓解。
首次出现应答的中位时间为1.2个月。
中位缓解持续时间(DOR)为24.0个月,在达到≥CR或更好缓解的患者中,中位DOR尚未达到。
此外,特立妥单抗在中国也于2024年6月获批上市,用于相同适应症的治疗。
不良反应与监测
特立妥单抗的使用可能伴随一些免疫相关的不良反应,主要包括细胞因子释放综合征(CRS)、免疫性血细胞减少、神经毒性等。因此,在使用特立妥单抗时,需要对患者进行密切监测,并采取必要的干预措施来管理这些不良反应。特别是在前3次剂量后,患者应在2天内每天监测副作用,并建议在医疗设施附近进行监测。
为了减少CRS的风险,在开始特立妥单抗治疗前,患者应接受预处理药物,包括皮质类固醇、抗组胺药和退热剂。此外,对于同时服用CYP450系统底物且治疗窗口较窄的患者,应密切监测其毒性或药物积累的迹象,并根据需要调整伴随用药的剂量。
综上所述,泰立珂/特立妥单抗作为一种新型的BiTE疗法,在复发性和难治性多发性骨髓瘤的治疗中展现出巨大潜力。其独特的作用机制和显著的临床疗效使其成为免疫治疗领域的重要进展,为癌症患者带来了更好的生存机会和生活质量。然而,在使用时仍需注意其可能的不良反应和药物相互作用,以确保患者的安全。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 特立妥单抗 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问