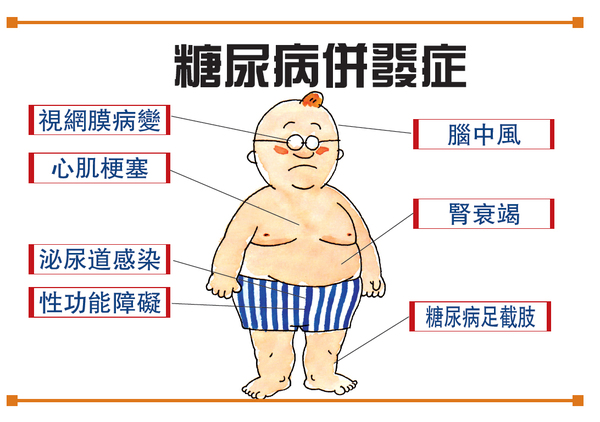
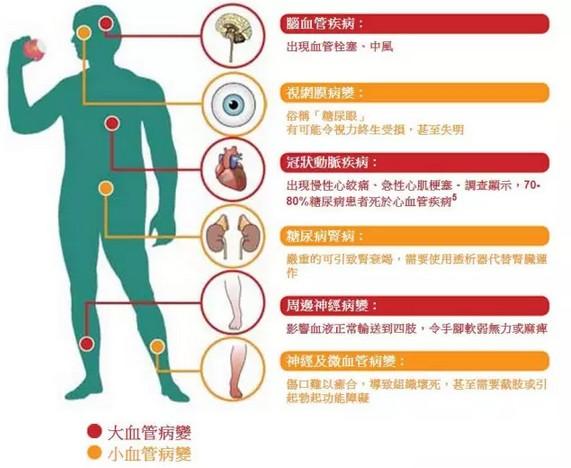
替尔泊肽是一款每周注射1次的GLP-1R/GIPR双重激动剂,于2022年5月首次获FDA批准上市,用于治疗2型糖尿病。2022年9月,替西帕肽该适应症的上市申请获得CDE受理。2022年10月,FDA已授予替西帕肽用于成人肥胖或超重的快速通道指定,礼来目前已向FDA滚动提交减重适应症上市申请。8月21日,礼来替西帕肽(替尔泊肽)用于改善肥胖或伴有至少一种体重相关合并症的超重成人患者的上市申请正式获药监局受理,同日礼来也公布了替西帕肽用于减重的中国III期SURMOUNT-CN研究结果。
SURMOUNT-CN是一项随机、双盲、安慰剂对照的III期研究,旨在评估每周注射1次替西帕肽在肥胖或至少有一种合并症的超重的非糖尿病成人患者的有效性和安全性,共入组了210例中国患者(基线体重均值为91.8kg、BMI均值为32.3kg/m2)。
结果显示,接受替西帕肽10mg、15mg治疗52周时,受试者体重较基线平均减轻14.4%、19.9%,优效于安慰剂组(-2.4%)。此外,替西帕肽10mg、15mg治疗组减重超过5%的患者比例分别为91.4%、92.7%,优效于安慰剂组(29.4%);而替西帕肽10mg、15mg治疗组减重超过15%的患者比例分别为48.6%、72.1%,也优效于安慰剂组(2.9%)。
总体而言,该研究达到了主要终点和所有关键次要终点,且未出现新的安全性信号,最常见的不良反应为轻度至中度胃肠道不良反应。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 替西帕肽 https://www.kangbixing.com/




 添加康必行顾问,想问就问
添加康必行顾问,想问就问