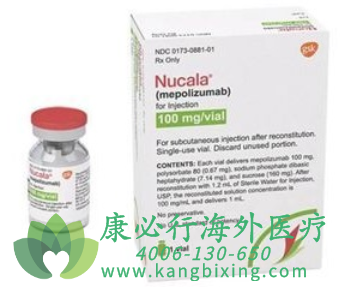
中国国家药品监督管理局(NMPA)官网最新公示,葛兰素史克(GSK)公司美泊利珠单抗(mepolizumab,商品名:新可来)注射液的新增适应症上市申请已被正式批准,该药本次获批作为一种联合维持疗法用于治疗重度嗜酸粒细胞性哮喘。关于美泊利珠单抗注射液
2021年,中国批准美泊利珠单抗注射液用于成人嗜酸性肉芽肿性多血管炎(EGPA)患者的治疗,并于2023年1月列入国家医保药品目录。此次,中国批准扩展其治疗范围用于成人和12岁及以上青少年重度嗜酸粒细胞性哮喘(SEA)的维持治疗。
新可来已在41个临床试验中对超过4000例患者、横跨多种嗜酸性粒细胞适应症进行了评估。在美国和欧洲,该药成为首个获批用于治疗四种由嗜酸性粒细胞增多引起的炎性疾病:重度嗜酸粒细胞性哮喘(SEA)、嗜酸性肉芽肿性多血管炎(EGPA)、高嗜酸性粒细胞综合征(HES)和慢性鼻窦炎伴鼻息肉(CRSwNP)的药物。截至目前,新可来已获美国、欧盟及其他超过25个市场批准,作为重度嗜酸粒细胞性哮喘患者的维持治疗。
这一获批是基于在中国患者中进行的独立的三期临床试验的积极结果,美泊利珠单抗在中国人群中的有效性巩固了其在广泛人群中的现有数据,显示了美泊利珠单抗能够减少重度哮喘患者病情加重。不良反应与美泊利珠单抗的已知安全性相符,没有出现针对中国患者的新的安全性问题。全球临床开发计划包括四项关键临床试验——DREAM、MENSA、SIRIUS和MUSCA——这些试验确立了美泊利珠单抗在治疗重度嗜酸粒细胞性哮喘患者中的有效性和安全性的表现。在重度嗜酸粒细胞性哮喘中,美泊利珠单抗的安全数据来自关键的、长期的临床研究和真实世界研究。
这项在中国患者中进行的为期52周的三期试验,研究了美泊利珠单抗作为重度嗜酸粒细胞性哮喘患者维持治疗的效果,主要终点为相较于安慰剂组具有临床显著意义的哮喘急性发作率的下降。
Nucala(mepolizumab)新可来(美泊利单抗)是一款靶向人抗白介素-5(IL-5)的单克隆抗体生物制剂,通过与IL-5结合,阻断IL-5与嗜酸粒细胞表面受体的结合,从而使血液中嗜酸粒细胞的数量降低并维持在正常水平。
IL-5是促进嗜酸粒细胞成熟、功能活化和存活的主要细胞因子,并且为嗜酸粒细胞从骨髓迁移至肺部及其他器官提供重要信号。根据一项真实世界的观察研究,高达80%的重度哮喘为嗜酸粒细胞性哮喘。
在美国,该药已获批用于治疗多种由嗜酸性粒细胞增多引起的炎性疾病,如重度嗜酸粒细胞性哮喘、嗜酸性肉芽肿性多血管炎、高嗜酸性粒细胞综合征、慢性鼻窦炎伴鼻息肉等。在中国,美泊利珠单抗此前已获批用于治疗成人嗜酸性肉芽肿性多血管炎(EGPA),并于2023年1月被正式纳入中国国家医保目录。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:美泊利单抗(NUCALA/MEPOLIZUMAB)治疗嗜酸粒细胞性肉芽肿性多血管炎的效果怎样?
更多药品详情请访问 美泊利珠单抗 https://www.kangbixing.com/drug/mepolizumab/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问