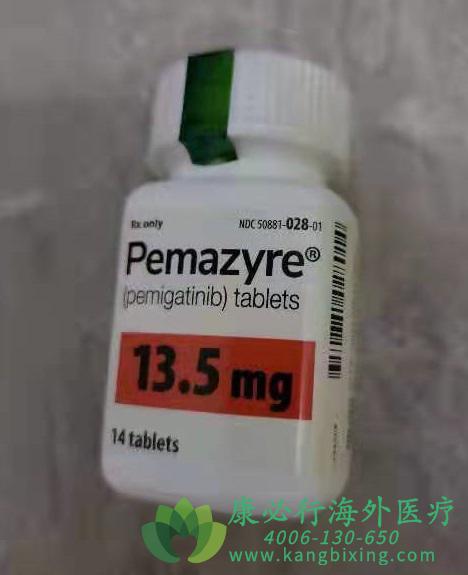
培米替尼是由信达生物和Incyte公司共同研发的一种选择性FGFR(纤维细胞生长因子受体)酪氨酸激酶抑制剂。它通过抑制FGFR1-3的磷酸化和信号传递过程,阻断由FGFR扩增和融合导致的FGFR信号的组成性激活,从而选择性地抑制肿瘤细胞的生长。特别地,培米替尼对FGFR2基因融合或其它重排的胆管癌患者具有高度针对性和高效性,这使得它在阻止肿瘤的生长和扩散上表现尤为优秀。
临床试验结果
2020年4月,美国食品药品监督管理局(FDA)基于FIGHT-202临床试验的结果,加速批准了培米替尼用于治疗FGFR2融合或重排的局部晚期或转移性胆管癌患者。FIGHT-202是一项多中心、开放标签的2期临床试验,旨在评估培米替尼在既往治疗效果不佳的局部晚期或转移性胆管癌患者中的安全性和疗效。
在FIGHT-202试验中,共入组了107名已接受过FGFR2融合或重排治疗的局部晚期或转移性胆管癌患者。这些患者每天口服一次培米替尼,起始剂量为13.5 mg,直至病情进展或出现不可耐受的毒性。试验结果显示,培米替尼的总缓解率达到36%,其中2.8%的患者实现完全缓解,33%的患者实现部分缓解。值得注意的是,在38例出现缓解的患者中,有24名患者(63%)的缓解持续时间达到6个月或更长,7名患者(18%)的缓解持续时间甚至达到12个月或更长。
此外,另一项在中国进行的多中心、开放性、单臂试验(CIBI375A201)也进一步验证了培米替尼在胆管癌患者中的疗效。该研究共入组了30例疗效可评价的受试者,结果显示客观缓解率(ORR)达到50%,均为部分缓解,且受试者总体不良反应发生比例和类别与FIGHT-202研究基本一致,表明培米替尼在中国胆管癌患者中也具有良好的疗效和安全性。
安全性与耐受性
尽管培米替尼在胆管癌治疗中表现出显著的疗效,但其安全性也是患者和医生关注的焦点。临床试验数据显示,培米替尼的毒性作用低,不良反应少,大多数不良反应为1-2级,整体安全性良好。常见的副作用包括腹泻、恶心、口味变化、呕吐、食欲不振、疲劳、脱发、便秘、口腔炎、口干和食欲下降等。然而,有些副作用可能较为严重,如视力模糊、眼球漂浮物、肌肉痉挛等,一旦出现这些症状,患者应立即联系医生或接受紧急治疗。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击扩展阅读:胆管癌用药培米替尼/佩米替尼(PEMIGATINIB)的功效与毒副作用说明
更多药品详情请访问 培米替尼 https://www.kangbixing.com/drug/pmtn/




 添加康必行顾问,想问就问
添加康必行顾问,想问就问