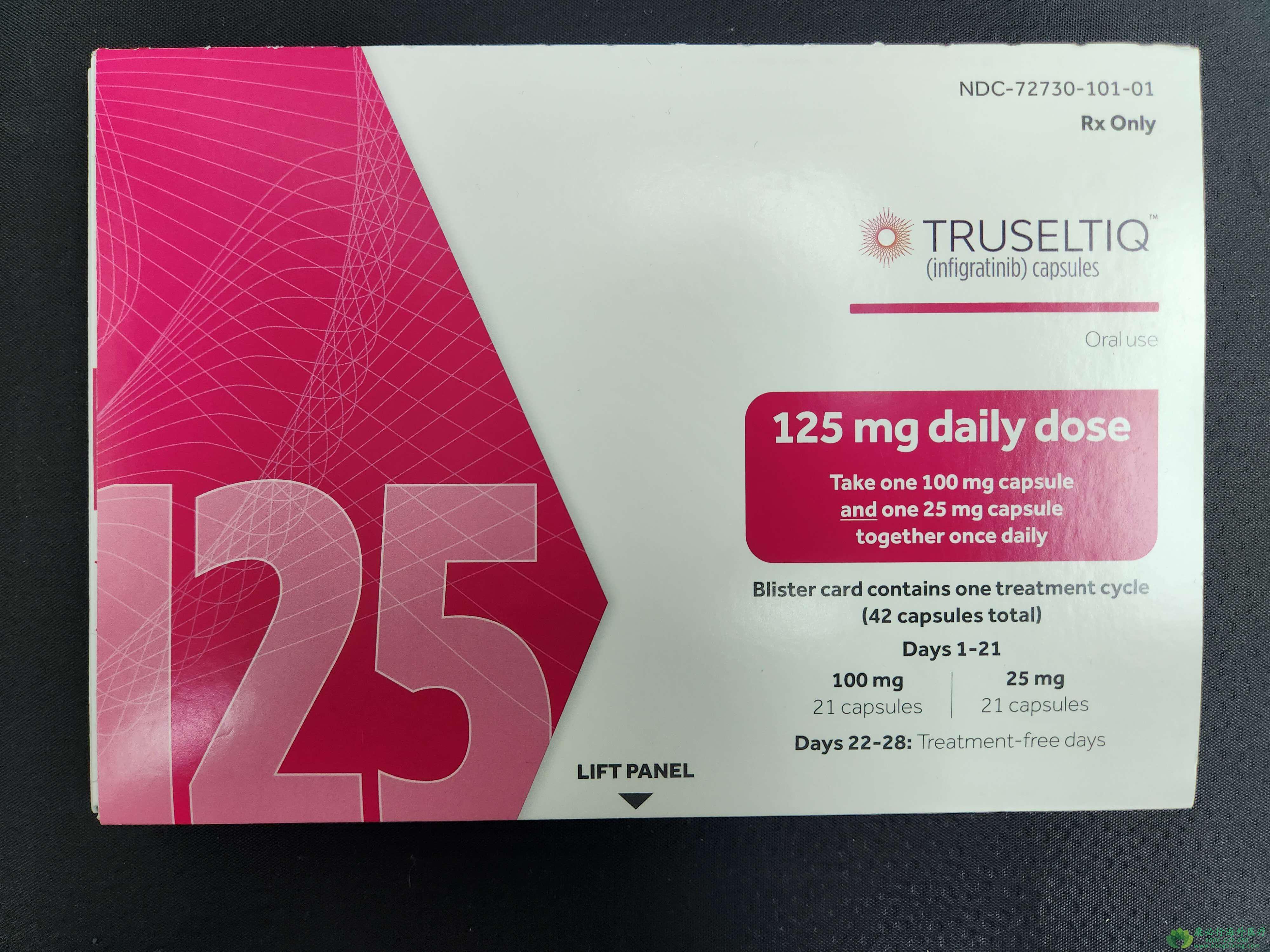
英菲格拉替尼(Infigratinib)是一种可口服的选择性成纤维细胞生长因子受体(FGFR)酪氨酸激酶抑制剂,FDA于2021年5月29日批准其上市,用于治疗FGFR2融合及重排突变的局部晚期或转移性胆管癌患者。FGFR抑制剂:胆管癌中,FGFR发生突变的频率约为7%,其突变类型包括融合(3.5%)、点突变或插入缺失(0.9%)、扩增(2.6%)。而FGFR2被发现是FGFR家族在胆管癌中最高频的突变基因,约为6.1%,以基因融合为主要突变形式。FGFR2基因融合突变基本上都出现在肝内胆管癌中。
2023年3月28日,国家药监局药品审评中心(CDE)官网公示,联拓生物引进的口服FGFR1-3选择性抑制剂Infigratinib(中文通用名:英菲格拉替尼)拟纳入突破性治疗品种,拟定适应症为:既往接受过至少两线系统性治疗的、伴有FGFR2基因扩增的局部进展期或转移性胃癌或胃食管结合部腺癌患者。
联拓生物计划在2024年上半年启动英菲格拉替尼治疗伴有FGFR2基因扩增的局部晚期或转移性胃癌患者的关键性II期试验,以支持其在中国的上市审批。2021年8月25日,联拓生物与生物技术公司BridgeBio Pharma宣布,在Infigratinib治疗局部晚期或转移性胃癌或伴有成纤维细胞生长因子受体-2(FGFR2)基因扩增的胃食管交界处腺癌和其他伴有FGFR基因组改变的晚期实体瘤的IIa期临床试验中,已完成首例患者治疗。
该项IIa期试验是一项在中国进行的多中心、开放标签、单臂研究,旨在评估Infigratinib在伴有FGFR2基因扩增的局部晚期或转移性胃癌或胃食管结合部腺癌患者,以及因FGFR基因变异导致的其他晚期实体瘤患者中的安全性和有效性。
试验的主要终点是客观缓解率(ORR);次要终点包括缓解持续时间(DOR)、疾病控制率(DCR)、无进展生存期(PFS)、总生存期(OS)以及安全性。
Truseltiq的获批是基于一项2期临床研究,包括108例既往接受过至少一种晚期CCA治疗的患者。这些患者中,107例(99%)为IV期CCA。研究结果显示,确认的客观缓解率(ORR)为23%(95%CI,16-32%),中位缓解持续时间(DOR)为5.0个月(95%CI,3.7-9.3个月)。
临床前数据表明,Infigratinib可能对胃癌患者有潜在的疗效。发表在Cancer Discovery杂志上的结果表明,在多个FGFR2扩增的胃癌模型中观察到肿瘤消退。
研究结果显示:接受英菲格拉替尼治疗的患者,整体缓解率为23.1%,中位无进展生存期7.3个月;发生响应的患者中,缓解持续超过6个月的患者占32.0%,中位缓解持续时间5.0个月。亚组分析结果显示,曾接受过二线治疗的患者整体缓解率为34%,三线治疗及以上的患者整体缓解率为13.8%;最多的患者曾接受过8种前线治疗方式。
安全性:Infigratinib常见不良反应为高磷酸盐血症(76.9%),眼部疾病(67.6%,不包括中央浆液性视网膜病变/视网膜色素上皮脱离[CSR/RPED]),口腔炎(54.6%),疲劳(39.8%)。16.7%的患者发生了CSR/RPED(其中1例为G3)。常见的3/4级TEAE是口腔炎(14.8%;均为G3),低钠血症(13.0%;均为G3)和低磷血症(13.0%;13例G3、1例G4)。
对于具有FGFR2基因融合或重排的晚期难治性胆管癌患者,英菲格拉替尼具有良好的抗癌活性和可控的AE谱。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:英菲格拉替尼(TRUSELTIQ)的用法用量与注意事项说明
更多药品详情请访问 英菲格拉替尼 https://www.kangbixing.com/




 添加康必行顾问,想问就问
添加康必行顾问,想问就问












