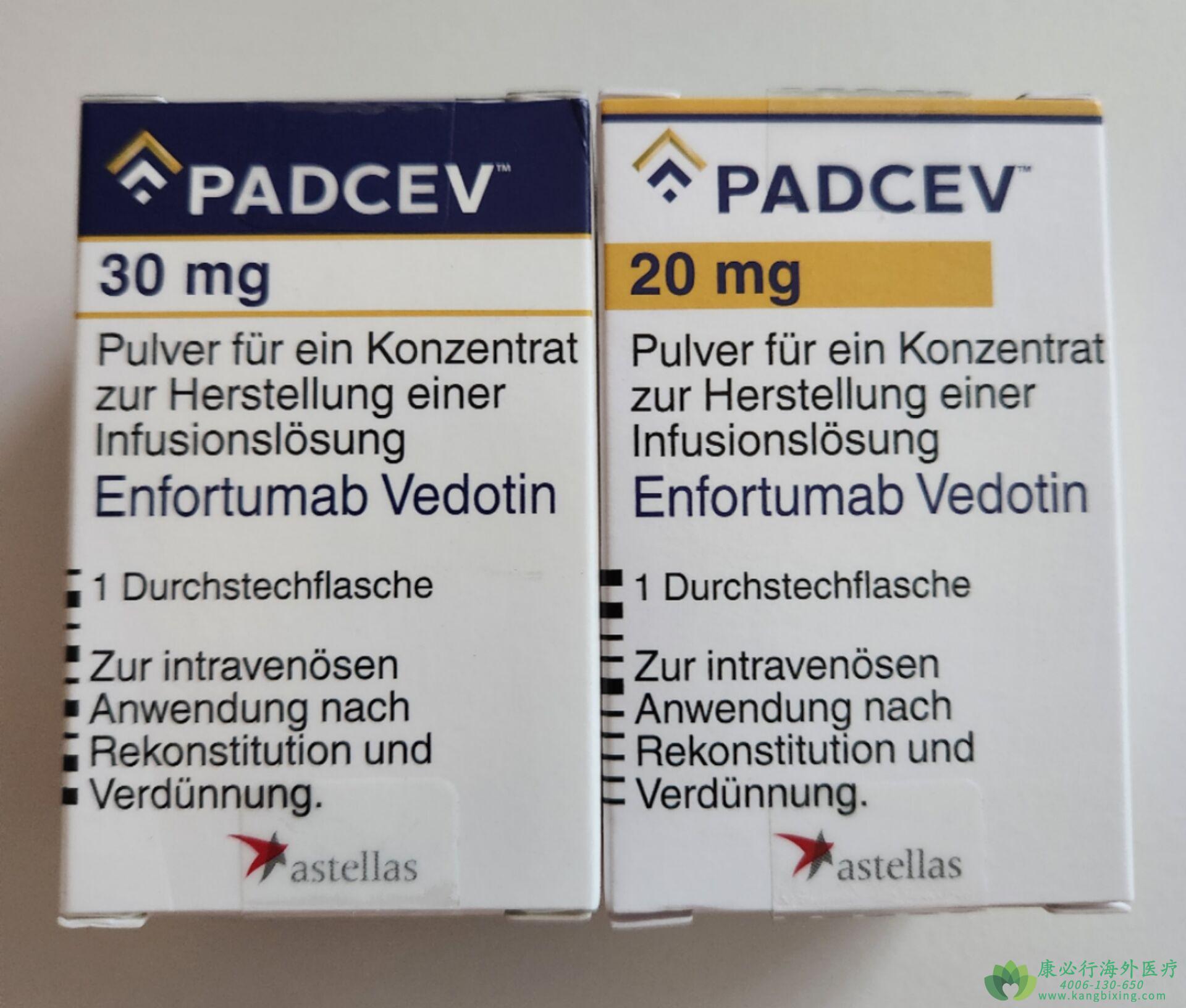
恩诺单抗PADCEV是一种Nectin-4定向抗体和微管抑制剂偶联物,适用于局部晚期或转移性尿路上皮癌成年患者,治疗先前已接受程序性死亡受体1(PD-1)抑制剂或程序性死亡配体1(PD-L1)抑制剂治疗,以及在新辅助/辅助、局部晚期或转移性环境中的含铂化疗的患者。该适应症是根据肿瘤反应率在加速批准下批准的。对于该适应症的持续批准可能取决于验证性试验中对临床益处的验证和描述。
剂量和给药•仅用于静脉输液。请勿以静脉推注或推注的方式给予PADCEV。请勿与其他药品混合或作为输注剂使用。
•PADCEV的推荐剂量为1.25 mg/kg(最大剂量为125 mg),在28天周期的第1、8和15天的30分钟内静脉输注,直至疾病进展或出现不可接受的毒性。
•避免在中度或重度肝功能不全的患者中使用剂量形式和强度注射用:20毫克和30毫克的enfortumab vedotin-ejfv(冻干粉)放在单剂量小瓶中,以进行重溶。
警告和注意事项
•高血糖症:糖尿病酮症酸中毒可能在有或没有既往存在糖尿病的患者中发生,这可能是致命的。密切监测患有糖尿病或高血糖症或有此风险的患者的血糖水平。如果血糖>250 mg/dL,则停用恩诺单抗PADCEV。
•周围神经病变:监测患者是否出现新的或恶化的周围神经病变,并考虑中断剂量,降低剂量或停用PADCEV。
•眼疾:可能发生眼疾,包括视力改变。监视患者眼部疾病的体征或症状。考虑干眼预防性人工泪液和眼科检查后用眼科局部类固醇治疗。当出现症状性眼部疾病时,考虑中断PADCEV的剂量或降低剂量。
•皮肤反应:如果严重,请暂缓使用PADCEV直至改善或解决。
•输液部位外溢:给药前确保足够的静脉通路。在PADCEV给药期间监视输液部位,并立即停止输注以防可疑渗出。
•胚胎胎儿毒性:恩诺单抗PADCEV可能引起胎儿伤害。建议对胎儿的潜在风险,并采取有效的避孕措施。
Enfortumab Vedotin是首个获批治疗尿路上皮癌的ADC药物,也是首个获批用于先前接受过含铂化疗和一种PD-1或PD-L1抑制剂的局部晚期或转移性尿路上皮癌患者的药物。今年3月,Enfortumab Vedotin在欧盟和日本申请上市。如果获得批准,该药将成为欧洲和日本第一个针对尿路上皮癌的ADC药物。
泌尿科肿瘤治疗的靶向药物策略试图确定NECTIN4表达是否在膀胱癌的分子亚型中存在异质性。使用来自7个临床队列和<1,900个患者样本的基因表达数据,泌尿科肿瘤治疗的靶向药物策略发现与基础、神经内分泌或富含基质的亚型相比,NECTIN4表达在膀胱癌的管腔分子亚型中最高。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:恩诺单抗(PADCEV/ENFORTUMAB)相关信息说明介绍
更多药品详情请访问 恩诺单抗  https://www.kangbixing.com/drug/Padcev/
https://www.kangbixing.com/drug/Padcev/




 添加康必行顾问,想问就问
添加康必行顾问,想问就问